Fettanalyse: schnell und nicht schmutzig
Fettanalyse: schnell und nicht schmutzig

Die „gute Butter“, Butterschmalz oder Margarine – sie alle sind kaum wegzudenken aus der feinen Küche. Was in welchem Streichfett enthalten sein darf, ist in der EU streng geregelt. Mithilfe der Molekülspektroskopie lässt sich im Rahmen der Lebensmittelanalyse schnell und ohne vorherige chemische Analysenvorbereitung ermitteln, ob in den Lebensmitteln auch das drin ist, was laut Verordnung drin sein sollte.
Goldgelb, fein im Geschmack und daher gern genutzt: Butter, Butterschmalz und Margarine. Aber was sind die Unterschiede zwischen den Fetten?
Fett ist nicht gleich Fett
Jede Art von Fettaufstrich hat ein anderes Verhältnis von Fett und Wasser. Nach den Rechtsvorschriften in der EU muss Butter einen Milchfettgehalt von mindestens 80 % und weniger als 90 % aufweisen. Es darf also nicht mehr als 16 % Wasser enthalten sein. Butter besteht überwiegend aus gesättigten Fettsäuren, ist gekühlt eher hart und wird erst durch Zusatz von Ölen streichfähig.
Butterschmalz ist Butter, aus der fast alles an Wasser, Milcheiweiß und Laktose durch langsames Erhitzen entfernt wurde. Dadurch hat es einen Fettgehalt von z. B. 99,8 % und eignet sich somit ideal zum Erhitzen. Der gesunde Aspekt soll ein hoher Vitamin-A-Gehalt sein, den es nachzuweisen gilt.
Margarine ist eine Emulsion aus pflanzlichen und/oder tierischen Fetten und Wasser oder Magermilch mit einem Fettgehalt zwischen 39 % und 90 %. Sie enthält daher normalerweise viel weniger Fett. Darüber hinaus gilt Margarine als gesund, weil sie reich an Vitaminen wie A, D und E ist. Jedoch werden diese dem Produkt hinzugefügt.
Das Wohlbefinden im Blick
Die Diskussion, welches dieser fetten Produkte das gesündeste oder hochwertigste ist, ist ein Dauerbrenner. Galt etwa in der Vergangenheit Margarine als „billiger Ersatz“ für die „gute Butter“, wird sie heute sogar als gesünder als die tierischen Fette angesehen und hat sich in der Riege der Brotaufstriche etabliert.
Um die Angaben der Verpackung, die Unbedenklichkeit, aber auch den ernährungsphysiologischen Nutzen von Fetten zu überprüfen, ist die Analyse von Speisefetten und -ölen mittels Infrarotspektroskopie eine bekannte Methode bei Lebensmittelkontrollen. Hersteller von Streichfetten und Ölen wollen etwa die genaue Zusammensetzung von gesättigten und ungesättigten Fettsäuren ihrer Produkte kennen, denn hohe Cholesterinwerte im Blut sind verantwortlich für Herz- und weitere Erkrankungen. Darüber hinaus interessiert die Ernährungsphysiologie, die sich über den cis/trans-Wert der ungesättigten Fettsäuren abbildet. Denn einige der ungesättigten Fettsäuren sind lebensnotwendig, wie zum Beispiel Linolsäure und die Arachidonsäure.
Die chemische Analyse sollte eine qualitative und quantitative Bestimmung von jeder Fettsäure/jedem Fettsäureester enthalten, jedoch ist diese Analyse sehr komplex und zeitaufwendig. Die Industrie hat daher Analysenzahlen (Fettkennzahlen), um die Fette zu charakterisieren und zu identifizieren. Dazu zählen vor allem Säurezahl, Verseifungszahl, Esterzahl oder Jodzahlen. Mit der Infrarotspektroskopie kann sehr genau die cis- und trans-Fettsäure bestimmt werden. Zu diesem Zweck wird zur Analyse für die ungesättigten cis-Fettsäuren das Signal bei 3010 cm-1 und die ungesättigte Transsubstituierte bei 966 cm-1 ausgewählt. Das Wasserspektrum liegt im Bereich von 3350 cm-1 in breiter Bande.
Schnelle Qualitätskontrolle
Mit der Infrarotspektroskopie ist es möglich, Fette einer schnellen Qualitätskontrolle zu unterziehen und ihren Wassergehalt zu bestimmen, ohne das Fett für die Analyse aufbereiten zu müssen. Untersucht wurden fünf handelsübliche Fette aus dem Supermarkt und die Ergebnisse mit den Angaben auf der Verpackung verglichen. Einmal fand die Analyse mittels Infrarotspektroskopie statt, um die Unterschiede im Wasseranteil aufzuzeigen. Des Weiteren kam die Fluoreszenzspektroskopie zum Einsatz, um das Vorhandensein von Vitamin A zu überprüfen. Die Fette wurden bei Raumtemperatur im festen Zustand gemessen.
Diese Streich- oder Bratfette unterscheiden sich grundsätzlich in ihrem Werdegang. Das eine sind tierische, das andere pflanzliche Fette, wobei die tierischen Fette weniger Wasser aufweisen als die pflanzlichen. Da in tierischen Fetten mehr Fettsäuren enthalten sind, kann man dort auch fettlösliche Vitamine erwarten, die in Spuren, aber grundsätzlich in höherer Konzentration als in pflanzlichen Fetten vorliegen. Allerdings können Vitamine den Margarinen auch bei der Herstellung untergemischt werden.
Da bei der Analyse die Schnelligkeit und Einfachheit, mit der Informationen über die Zusammensetzung gewonnen werden, im Vordergrund standen, galt für beide Techniken die Zielsetzung, die Analyse mit einfacher Probenvorbereitung ohne chemische Vorbehandlung der Fette durchzuführen. Sollen darüber hinaus Inhaltsstoffe ermittelt werden, die in Spuren vorliegen, dann kommen andere Analysenverfahren und Techniken wie zum Beispiel die Chromatografie infrage oder – wenn es um elementspezifische Inhaltsstoffe geht – sind die Analysentechniken EDX, AAS, und ICP ratsam. [1], [2], [3]
Einfach auftragen, schnell reinigen: Probenvorbereitung und -analyse
Die Probenvorbereitung ist für beide Messtechniken einfach: Beim Fourier-Transform-Infrarotspektrometer (FTIR) wird das Fett mit dem Spatel auf das Messfenster blasenfrei aufgetragen. Für die Fluoreszenzspektroskopie wird die sogenannte „FrontFace“-Analyse angewendet. Dazu wird ein Probenhalter des Feststoffprobenhalters mit dem Fett bis zur Kante gefüllt und mit einer Quarzplatte abgedeckt, sodass der Quarz Kontakt mit dem Fett hat. Dies wird in den Feststoffprobenhalter in den Probenraum gegeben.
Bei der Infrarotspektroskopie kam ein Shimadzu IRSpirit-T FTIR-Laborgerät zum Einsatz, ausgerüstet mit einem diamantbasierenden ATR-Zubehör für eine Messung in Einfachreflexions-ATR. Der Diamant ist robust und lässt sich einfach pflegen. Das Messfenster – nur 2 mm groß – wird mit Papier abgerieben bis zur subjektiven Fettfreiheit und dann mit einem fettlösenden Reiniger bis zur absoluten Fettfreiheit nachgearbeitet. Insgesamt beträgt der Reinigungsaufwand unter einer Minute und das Zubehör ist sofort einsatzbereit für die nächste Probe.
Zur Fluoreszenzspektroskopie zum Nachweis der Vitamine, seien sie natürlich oder beigemischt, wurde das Shimadzu RF-6000 Fluoreszenzspektrometer eingesetzt. So lässt sich beispielsweise Vitamin A, das sich im Fett gelöst befindet, ohne chemische Vorbereitungen über die Fluoreszenz messen und bestimmen. Zur Reinigung wird auch hier Papier benutzt bis zur offensichtlichen Fettfreiheit von Probengefäß und Quarzplatte und das Ganze mit einem fettlösenden Mittel nachgearbeitet. Der Aufwand der Reinigung beträgt hier unter fünf Minuten.
|
Diverse Kochfette und Aufstriche |
|
|
Typ |
Beschreibung |
|
Ghee/Butterschmalz von Kuhmilch |
Geklärte Butter mit einem Fettgehalt von 99,8g auf 100g. |
|
Butter |
Butter von der Kuhmilch mit einem Fettgehalt von 82,5g auf 100g, Wassergehalt ~17,5g |
|
Butter plus |
Butter von der Kuhmilch plus Rapsöl, eine Mischung aus 63% Butter und |
|
Margarine |
Soft Margarine mit einem Fettgehalt von 60g auf 100g und 800µg Vitamin A, |
|
Margarine |
Backen und Kochen – Margarine mit einem Fettgehalt von 70g auf 100g, Wassergehalt ~30g |

Der erste Blick – Ergebnisse der Infrarotspektroskopie
Die mittleren Infrarotspektren zeigen für die wasserarmen Fettspektren ein scharfes Signal bei 966 cm-1. Dies ist ein deutlicher Hinweis auf trans-substituierte Fettsäuren, Doppelbindungen, die für die Weichheit oder Streichfähigkeit des Fettes verantwortlich sind. So findet man sehr viele trans-Fettsäuren in Ölen und anteilsweise weniger in Butter und Margarine. Bei Letzteren werden diese sogenannten „guten“ Fette synthetisch hinzugefügt. Eine der für die Analyse ausgewählten Buttersorten ist mit einem Rapsöl versetzt worden, um die Anteile trans-Fettsäuren zu erhöhen.
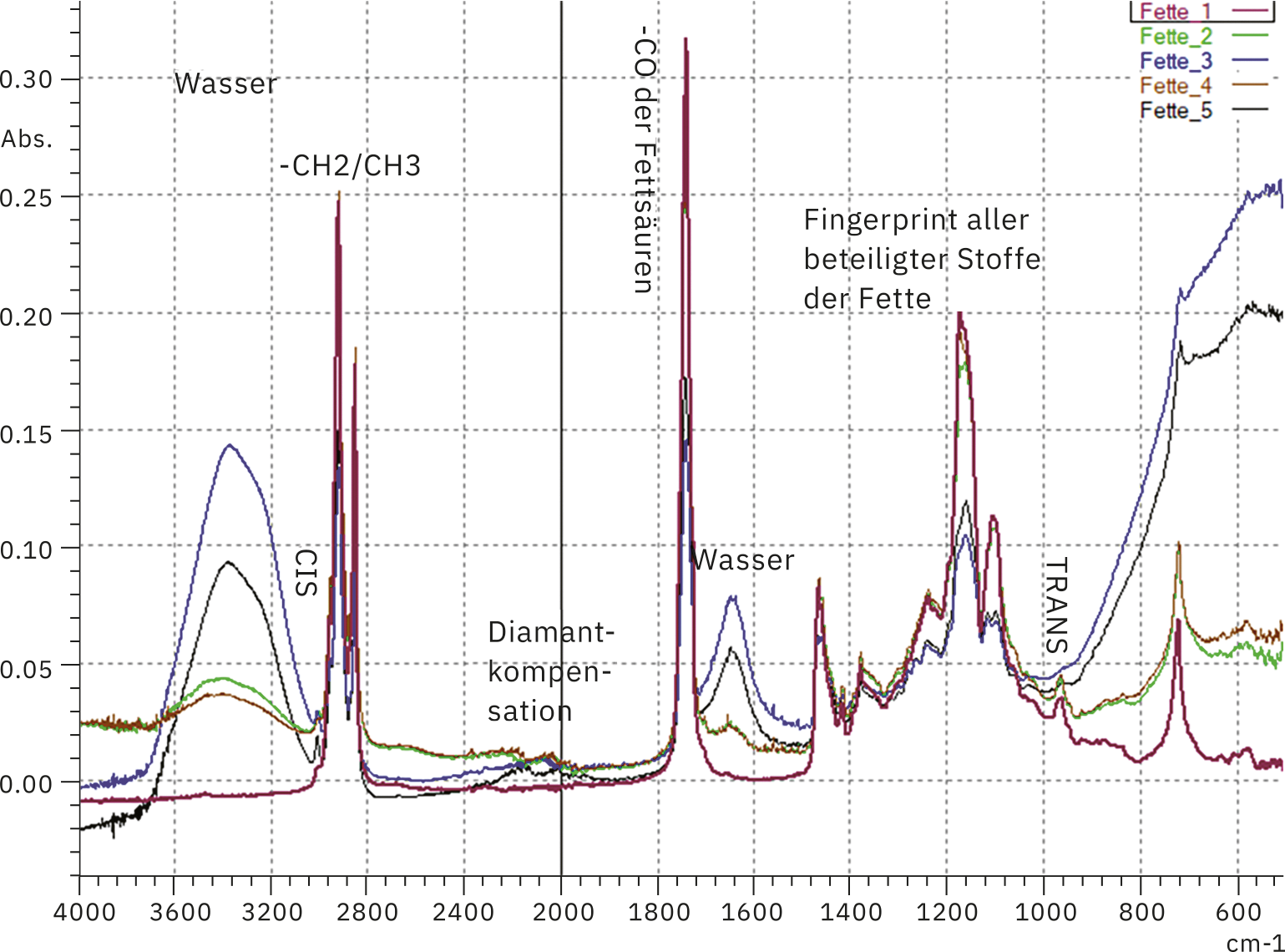
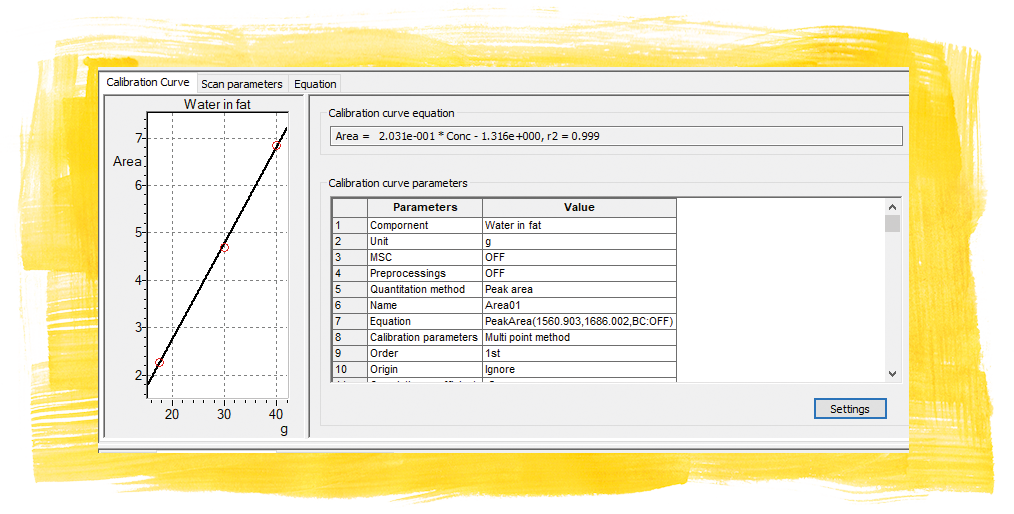
Der Analysenbereich lässt sich um einige Inhaltsstoffe erweitern. Dies ist hilfreich, wenn es sich um eine Vielzahl an Produkten handelt. So ist der Wassergehalt einfach zu bestimmen und zeigt sich deutlich in den Spektren der fünf untersuchten Proben (Abbildung 2). Dazu wurden die Werte, die auf der Verpackung angegeben waren, für eine Kalibration des Wassersignals verwendet. Die erstellte Kalibration konnte für die Wassergehaltbestimmung weiterer industriell produzierter Streichfette genutzt werden.
|
Bandenlage |
Zuordnung |
Zuordnung Methode |
Zuordnung Fette und Intensität |
|
3720-3040 |
Kristallwasser, weiter Bereich |
Butter niedrig, Margarine hoch |
|
|
Cis- orientierte Doppelbindung der Fettsäuren |
CIS-Trans |
Butter, Margarine |
|
|
2980-2820 |
Region der CH2/CH3 Schwingungen |
alle Spektren |
|
|
2400-1900 |
Effekt durch Diamantkompensation |
alle Spektren |
|
|
1700-1750 |
CO der Fettsäure |
OH-Zahl/IOD Zahl/Verseifung |
Butter, Butterschmalz hoch, Margarine niedriger |
|
Wassersignale |
Wasser |
Margarine hoch, Butter niedrieger |
|
|
1500-1000 |
Fingerprint Festtsäuren und Offset Wasser |
alle Spektren |
|
|
Trans – orientierte Doppelbindung der Fettsäure |
CIS-Trans |
Butter, Butterschmalz, Margarine wenig und nicht exakt bestimmbar (Wasser überlagert) |
|
|
900 bis 400 |
offset Wasser |
Margarine intensiv |
|
|
722cm-1 |
Deformation CH2 rocking scharfes Signal |
Butterschmalz, Butter Margarine wenig und nicht exakt |
Für das Butterschmalz wurde der Inhalt mit 99,8 g Fett und 0 g Wasser deklariert. Dies fand seine Bestätigung im Infrarotspektrum. Das Fettspektrum enthielt keine Wasserbanden. Alle anderen Fette (Margarine und Butter) wiesen Wasser auf, wurden in die Kalibration eingebracht und es fand eine Quantifizierung der vorgefundenen Wasserbanden (bei 1650 cm-1 unter der Annahme, dass der Wassergehalt die 100 g auffüllt, unter Vernachlässigung der Inhaltsstoffe im Spurenbereich) statt. Wegen der Breite der Wasserbande wurde eine Flächenkalkulation gewählt, um über das Mittel des Signals akkurater zu werden.
Mit guter Übereinstimmung der Wassergehalte wurde das Mischfett „Butter plus Öl“ als Unbekannte zur Prüfung der Kalibration eingesetzt. Dies ergab einen Wassergehalt von 17,8 g. Dies korreliert in der Größenordnung zur rapsölfreien Variante der Butter (17,5 g) gleicher Marke.
Der zweite Blick – Ergebnisse der Fluoreszenzspektroskopie
Dieselben Fette wurden mit der Fluoreszenzspektroskopie gemessen unter Ausführung einer EEM-Matrix. Dazu wurde für die Analyse die Anregungswellenlänge gegen das Emissionsspektrum stufenweise erhöht. Zur grafischen Darstellung wurden die Wellenlängen der Emissionsspektren (x-Achse) gegen die Anregungswellenlängen (y-Achse) aufgetragen. Diese Flächendiagramme weisen fluoreszenzaktive Bereiche aus. Bereiche, Intensitätswolken oder Hotspots entstehen durch Einzelsubstanz oder Familien, wie zum Beispiel Vitamine zu klassifizieren sind. In diesem Beispiel sind es Retinol (Vitamin A, Region A) und Tocopherol (Vitamin E, Region E), sowie UV-aktive Inhaltsstoffe als Matrix (Region M).
Die EEM-Matrix des Butterschmalzes zeigte deutlich ein durch das Vitamin A induziertes Spektrum, während die Butter und Margarine darüber hinaus noch andere Emissionsbereiche aufzeigten. Diese können den restlichen Inhaltsstoffen von Butter und Margarine, wie Vitamine, Eiweiße und Wasser, zugeordnet werden.
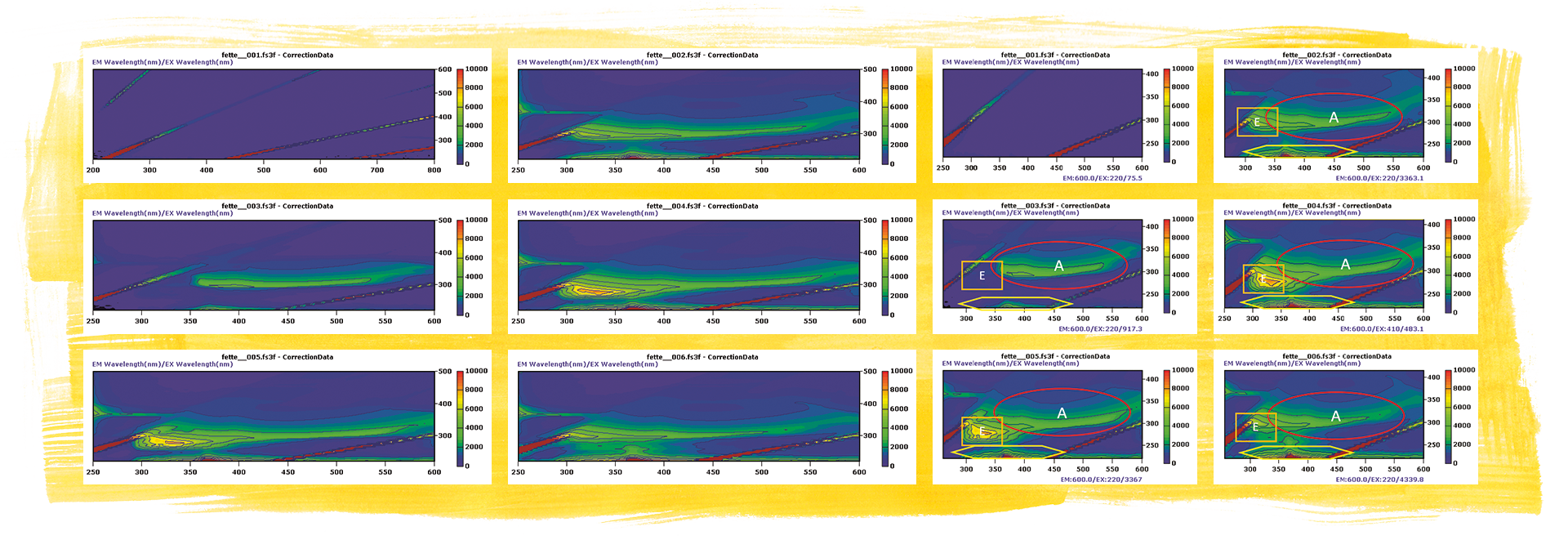
Weiche Margarine (Fette 3, oben rechts), Butterschmalz (Fette 1, Mitte links), Butter-und-Öl-Mix (mittig rechts), Butter (Fette 4, unten links), Margarine zum Backen (Fette 5, unten rechts).
Das Butterschmalz weist eine Region auf, die dem Vitamin A zugeordnet werden kann und zeigt eine wenig intensive Aktivität im Bereich der UV-Matrix. Alle anderen EEM-Matrizen zeigen zudem einen weiteren intensiven Eintrag im Bereich E, der das Vitamin A teilweise überlagert. In der Literatur wird diskutiert, ob diese Fluoreszenz von Proteinen und Kohlenhydraten in Verbindung mit dem Restwasser verursacht wird oder ob dort weitere Vitamine angeregt werden. Bester Treffer wäre dazu Vitamin E. Vitamin E (EX 285 EM 330) wird einigen Fetten auch aufaddiert. Vitamin E (Tocopherol) ist das Hauptvitamin in Rapsöl und anderen natürlichen Fetten, was zu dem intensiven Spot der Butter mit Rapsöl passen würde, während die „reine“ Butter an dieser Stelle etwas geringere Fluoreszenz aufweist. Die Margarinen geben in dieser Position keinen intensiven Hotspot.[4], [5]
|
Vitamin |
Fett |
durchschn. Menge/100g |
theor. Fluoreszenz |
Gemessene Fluoreszenz |
|
A |
Butter |
653µg |
EX:322/EM:340 540nm[3] |
Überlagert 340-350nm |
|
Rapsöl* |
550µg |
|||
|
Butter mit Rapsöl |
Überlagert 340-350nm |
|||
|
Margarine 1 |
608µg |
|||
|
Margarine 2 |
Nicht deklariert |
|||
|
Butterschmalz |
883µg |
EX:322/EM:340 540nm |
||
|
E |
Butter |
2000µg |
EX:285/EM:330[4] |
280-325 |
|
Rapsöl* |
18880µg |
|||
|
Butter mit Rapsöl |
280-325 |
|||
|
Margarine 1 |
nicht deklariert |
Nicht intensiv |
||
|
Margarine 2 |
nicht deklariert |
Nicht intensiv |
||
|
Butterschmalz |
nicht deklariert für die unter-suchte Marke, in der Literatur werden 3200µg angegeben |
– |
||
|
Matrix |
alle |
UV-aktiv |
Mehr und weniger intensive. |
EX250/EM 300-450nm |
Zeit ist Geld
Der Test bestätigt: Mit der ATR-Infrarotspektroskopie lassen sich die Fettspektren einfach und schnell identifizieren, auf die Inhalte an gesättigten und ungesättigten Fettsäuren (cis/trans) prüfen und der Wassergehalt kann bestimmt werden. Für eine produktspezifische Kalibration sollten robuste Quantifizierungen aufgestellt werden, weil die natürlichen Fette sich nicht an theoretische Kalibrationen mit Korrelationskoeffizienten mit dem Wert 1 halten, sie variieren, deshalb der robuste Modelle (Korrelationswert: 0.9x).
Die Fluoreszenzspektroskopie zeigt eine andere Sicht auf die Lebensmittel. Chemisch unbehandelt, als Feststoff, können Fette klassifiziert werden. Es kann einfach gegen ein Referenzmaterial gemessen werden und so eine Qualitätskontrolle in Bezug auf Vitamine durchgeführt werden.
Der Messaufwand beider Systeme ist zeitlich gering im Vergleich zur Reinigung der Messzubehöre. Eine Analyse könnte für beide Gerätesysteme zusammen unter 10 Minuten bleiben.
Referenzen
- Butter Ordinance, ButtV dated 1997
- Shimadzu C180E059C Food Analysis Guidebook, 2014
- Shimadzu SCA 110 017, Iodine number determination using FTIR–ATR spectroscopy
- Per A. Peterson and Lars Rask, Studies on Human Vitamin A-transporting Plasma Protein Complex and Its Individual Components, The Journal of Biological Chemistry, Vol. 240, No. 24, Issue of December 25, pp. 7544–7550, 1971
- Etsuo Niki and Kouichi Abe, CHAPTER 1: Vitamin E: Structure, Properties and Functions, in Vitamin E: Chemistry and Nutritional Benefits, 2019, pp. 1–11, DOI: 10.1039/9781788016216-00001
eISBN: 978-1-78801-621-6