Hochwertige Analyse auch bei geringer Konzentration
Bewertung eines MRM-Verfahrens zur Bestimmung von PAK in Palmöl mittels GC-MS/MS
Waldemar Weber, Shimadzu Europa GmbH, Elvi Horiyanto, Cynthia Lahey, Shimadzu Asia Pacific
Polyzyklische aromatische Kohlenwasserstoffe (PAK) sind eine Gruppe von organischen Verbindungen, die hauptsächlich durch die unvollständige Verbrennung organischer Stoffe entstehen. PAK sind karzinogene, teratogene und mutagene Kontaminanten und für den Menschen giftig. Eine Hauptquelle für die Exposition gegenüber PAK sind Lebensmittel und besonders Speiseöle und -fette aufgrund ihrer lipophilen Eigenschaften und des hohen Konsums dieser Erzeugnisse. Mit einem neuen Multiple-Reaction-Monitoring-Verfahren (MRM) können PAK in Palmöl selbst in geringer Konzentration nachgewiesen werden.
Polyzyklische aromatische Kohlenwasserstoffe (PAK) können auf natürliche Weise oder durch den Trocknungsprozess während der Produktion in Lebensmittel gelangen. 2002 identifizierte das „Scientific Committee on Food“ (SCF) 15 PAK, die als genotoxisch und karzinogen gelten. 2005 ergänzte das „Joint FAO/WHO Expert Committee on Food Additives“ (JECFA) diese Liste um einen weiteren PAK zur sogenannten „15+1 EU Priority PAH“.
Auf Grundlage dieser Liste legt die Verordnung (EU) Nr. 835/2011 den Höchstgehalt an Benzo[a]pyren und die Summe der PAK Benzo[a]pyren, Benz[a]anthracen, Benzo[b]fluoranthen und Chrysen in Speiseöl auf 2,0 μg/kg bzw. 10,0 μg/kg fest. Dieser Artikel beschreibt die Etablierung und Bewertung eines neuen Multiple-Reaction-Monitoring-Verfahrens (MRM) zur qualitativen und quantitativen Bestimmung der 15+1 PAK in Palmöl mit Anwendungen für andere Öle und Fette.
Versuchsbedingungen
Für diesen Versuch wurde ein Triple-Quadrupol GCMS-TQ8050 NX eingesetzt. Die Einzelheiten zum verwendeten GC-MS/MS-System und zu den analytischen Bedingungen des Verfahrens sind in Tabelle 1 aufgeführt. Alle 15+1 PAK wurden mit quantitativen und qualitativen MRM-Übergängen gemessen. Genaue Angaben zu den MRM-Übergängen, den Kollisionsenergie-Werten (CE) und den internen Standards (IS) finden sich in Tabelle 2.
Standards und Probenvorbereitung
Der Matrix-Blank wurde mit Palmöl aus Indonesien vorbereitet. Eine EU 15+1 PAK-Standardmischung (100 mg/L) wurde von Restek Corporation, USA, eingekauft. Chrysen-d12- und Perylen-d12-Standards kamen von Cambridge Isotope Laboratories Inc., USA. Matrixnahe IS-Kalibrierlösungen wurden anschließend im Matrix-Blank entsprechend vorbereitet. Die 15+1 PAK-Proben wurden in einer Konzentration von 0,2, 0,5, 1, 2, 5 und 10 μg/l vorbereitet (das entspricht 0,44 bis 22,34 μg/kg, je nach Gewicht des verwendeten Palmöls). Alle Kalibrierlösungen enthielten einen IS in der Konzentration von 5 μg/l Chrysen-d12 und 5 μg/l Perylen-d12. Zur Bestimmung der Wiederfindungsrate wurde der Matrix-Blank vor der Extraktion mit der PAK-Standardmischung und internen Standards zugegeben und anschließend analysiert.
|
Systemkonfiguration |
|
|
GC-MS-System |
GCMS-TQ8050 NX |
|
Flüssigsampler |
|
|
Gaschromatographieparameter |
|
|
Kapillarsäule |
SH-I-PAH |
|
Injektionsmodus |
Splitless, 330 °C |
|
Flusskontrollmodus |
Lineare Geschwindigkeit 50,0 cm/s |
|
Trägergas |
Helium |
|
Temp. program |
110 °C für 5 min, 30 °C/min bis 240 °C |
|
MS parameters |
|
|
Ionisationsmodus |
EI |
|
Temp. Ionenquelle |
230 °C |
|
Temp. Interface |
300 °C |
|
Modus |
MRM |
|
Analyt |
MRM-1 |
CE (V) |
MRM-2 |
CE (V) |
|
Benzo[c]fluoren |
216,1 > 215,1 |
22 |
216,1 > 189,1 |
30 |
|
Benzo[a]anthracen |
228,1 > 226,1 |
28 |
228,1 > 202,1 |
26 |
|
Chrysen-d12 (IS) |
240,2 > 236,2 |
28 |
240,2 > 238,2 |
26 |
|
Cyclopenta[c,d]pyren |
226,1 > 224,1 |
38 |
226,1 > 200,1 |
30 |
|
Chrysen |
228,1 > 226,1 |
28 |
228,1 > 202,1 |
26 |
|
5-Methylchrysen |
242,1 > 239,1 |
32 |
242,1 > 215,1 |
22 |
|
Benzo[b]fluoranthen |
252,1 > 250,1 |
28 |
252,1 > 226,1 |
30 |
|
Benzo[j]fluoranthen |
252,1 > 250,1 |
30 |
252,1 > 226,1 |
30 |
|
Benzo[k]fluoranthen |
252,1 > 250,1 |
30 |
252,1 > 226,1 |
30 |
|
Benzo[a]pyren |
252,1 > 250,1 |
30 |
252,1 > 226,1 |
24 |
|
Perylen-d12 (IS) |
264,2 > 260,2 |
47 |
264,2 > 262,2 |
44 |
|
Indeno[1,2,3-cd]pyren |
276,1 > 274,1 |
34 |
276,1 > 250,1 |
30 |
|
Dibenzo[a,h]anthracen |
278,1 > 276,1 |
30 |
278,1 > 252,1 |
30 |
|
Benzo[g,h,i]perylen |
276,1 > 274,1 |
32 |
276,1 > 275,1 |
28 |
|
Dibenzo[a,l]pyren |
302,1 > 300,1 |
36 |
302,1 > 298,1 |
60 |
|
Dibenzo[a,e]pyren |
302,1 > 300,1 |
36 |
302,1 > 276,1 |
28 |
|
Dibenzo[a,i]pyren |
302,1 > 300,1 |
36 |
302,1 > 276,1 |
28 |
|
Dibenzo[a,h]pyren |
302,1 > 300,1 |
36 |
302,1 > 276,1 |
28 |
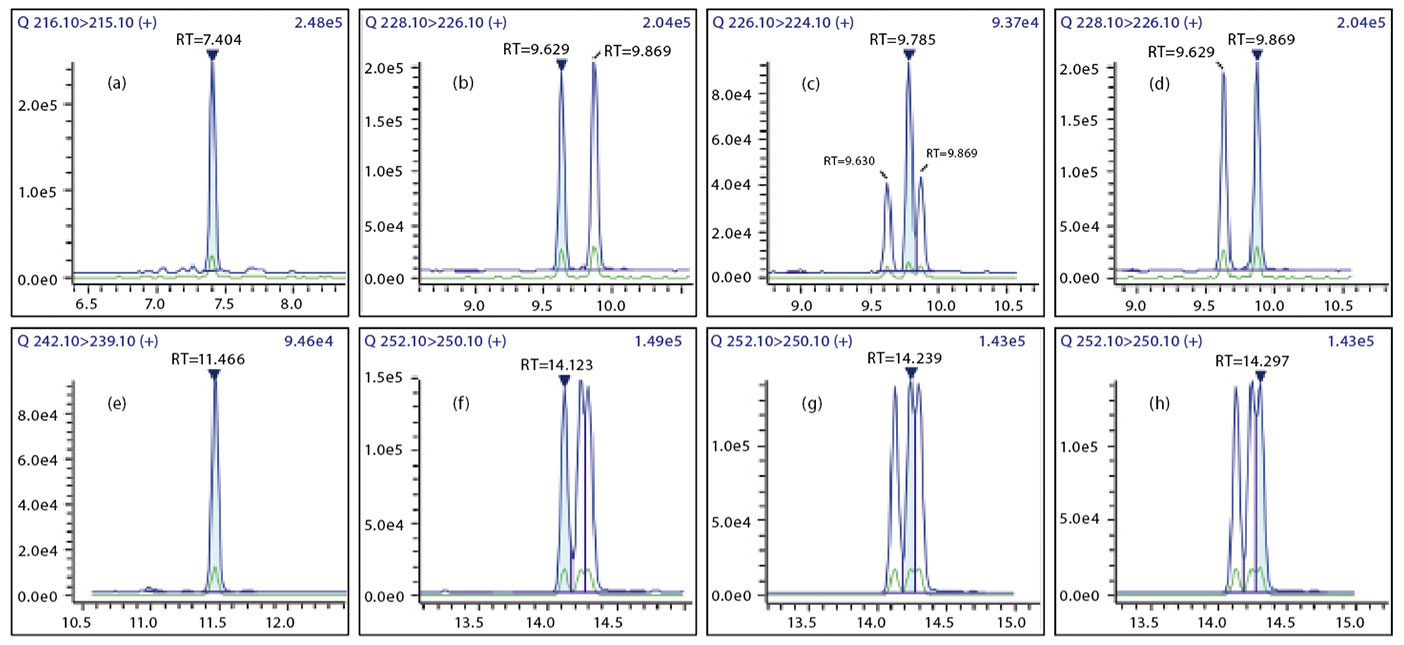
Detektion und Trennung
Die 15+1 PAK wurden im GC-MS/MS mit einer SH-I-PAH Säule getrennt. Die Massenchromatogramme aller Verbindungen sind in Abbildung 1 dargestellt.
Kalibrierbereich, Linearität und Quantifizierung
Für die 15+1 PAK wurden IS-Kalibrierkurven mithilfe entsprechender matrixnaher Kalibrierlösungen erstellt. Der Kalibrierbereich für die einzelnen PAK ist in Tabelle 3 angegeben. Die Kalibrierkurven aller PAK zeugten von einer ausgezeichneten Linearität mit einem R2-Wert von mindestens 0,9979 (Tabelle 3). Die Quantifizierung der Palmölprobe erfolgte durch Analyse der mit internen Standards dotierten Palmöl-Matrix-Blank. In dieser Palmölprobe wurde keiner der 15+1 PAK festgestellt.
|
Analyt |
Kalibrierbreich µg/l |
R2 |
Konz. der gespikten Probe für Wiederfindungstest µg/kg |
Wiederfindung % |
|
Benzo[c]fluoren |
1,0–10 |
0,9994 |
6,53 |
58 |
|
Benzo[a]anthracen |
0,5–10 |
0,9995 |
8,50 |
76 |
|
Cyclopenta[c,d]pyren |
0,5–10 |
0,9997 |
10,32 |
92 |
|
Cyclopenta[c,d]pyren |
0,5–10 |
0,9997 |
10,32 |
92 |
|
Chrysene |
0,5–10 |
0,9985 |
9,84 |
88 |
|
5-Methylchrysen |
0,2–10 |
0,9993 |
9,12 |
82 |
|
Benzo[b]fluoranthen |
0,2–10 |
0,9991 |
8,98 |
80 |
|
Benzo[j]fluoranthen |
0,2–10 |
0,9987 |
8,26 |
74 |
|
Benzo[k]fluoranthen |
0,2–10 |
0,9985 |
9,48 |
85 |
|
Benzo[a]pyren |
0,2–10 |
0,9989 |
9,35 |
84 |
|
Indeno[1,2,3-cd]pyren |
0,2–10 |
0,9988 |
9,44 |
85 |
|
Dibenzo[a,h]anthracen |
0,2–10 |
0,9990 |
9,49 |
85 |
|
Benzo[g,h,i]perylen |
0,2–10 |
0,9991 |
9,45 |
85 |
|
Dibenzo[a,l]pyren |
0,2–10 |
0,9986 |
9,01 |
81 |
|
Dibenzo[a,e]pyren |
0,2–10 |
0,9981 |
9,64 |
86 |
|
Dibenzo[a,i]pyren |
0,2–10 |
0,9979 |
9,85 |
88 |
|
Dibenzo[a,h]pyren |
0,5–10 |
0,9988 |
9,25 |
83 |
Zur Berechnung der Wiederfindungsrate wurde der Matrix-Blank mit 5 μg/l (entspricht 11,173 μg/kg in Palmöl) internen Standards und PAK gespikt. Die Konzentrationen wurden anschließend mithilfe der IS-Kalibrierkurven bestimmt. Die Wiederfindungsrate bei den sogenannten PAK4 (Benzo[a]pyren, Benzo[a]anthracen, Benzo[b]fluoranthen und Chrysen) lag zwischen 76,15 % und 88,11 %; dies entspricht den Kriterien der Verordnung (EU) Nr. 836/2011 (50–120 %). Die Ergebnisse zur Quantifizierung und Wiederfindungsrate zu der mit den 15+1 PAK dotierten Palmölprobe sind in Tabelle 3 aufgeführt. Dabei ist zu beachten, dass Triphenylen, das denselben MRM-Zielübergang wie Chrysen aufweist, die Quantifizierung von Chrysen stören könnte. Daher empfiehlt sich die Bestätigung mit einer anderen Säule, um die Quantifizierung zu verifizieren, sofern die Konzentration von Chrysen den festgelegten Höchstgehalt überschreitet.
LOD, LOQ und Wiederholbarkeit
Die Nachweisgrenze (LOD) bei allen 15+1 PAK in der Palmölprobe wurde im Bereich von 0,038–0,327 μg/kg bzw. bei den PAK4 im Bereich von 0,071–0,157 μg/kg ermittelt. Die berechnete Bestimmungsgrenze (LOQ) lag bei den 15+1 PAK zwischen 0,127 und 1,090 µg/kg und bei den PAK4 zwischen 0,236 und 0,522 µg/kg. Laut der Verordnung (EU) Nr. 836/2011 sollte die LOD für PAK weniger als 0,30 µg/kg bei einer LOQ von unter 0,9 µg/kg betragen. Dementsprechend zeigt die hier angewendete GC-MS/MS-Methode, dass sich per MRM-Detektion selbst geringe Konzentrationen von PAK in Palmöl nachweisen lassen. Die Genauigkeit der Analysemethode wurde durch acht aufeinanderfolgende Messungen der Kalibrierlösungen mit geringer Konzentration (0,5 μg/l) und mittlerer Konzentration (5 μg/l) in der Matrix durchgeführt. Die relative Standardabweichung (%RSD) des Peakflächenverhältnisses aller PAK gegenüber dem jeweiligen IS betrug < 8 % und < 5 % bei geringer bzw. mittlerer Konzentration. Für weitere Erkenntnisse wurde die 5 μg/l Kalibrierlösung in der Matrix innerhalb von 48 Stunden noch 72- mal analysiert. Die relative Standardabweichung (%RSD) des Peakflächenverhältnisses aller PAK (72) gegenüber dem jeweiligen IS betrug < 5 % (außer bei Dibenzo[a,i]pyren, wo er bei < 8 % lag). Diese Ergebnisse zeugen von einer hohen Stabilität und Genauigkeit des optimierten MRM-Verfahrens. Eine Zusammenfassung der Werte findet sich in Tabelle 4.
|
Analyt |
Berechnete LOD [µg/kg] |
Berechnete LOQ [µg/kg] |
Flächenverhältnis %RSD bei 0,5 µg/l Lösung (n=8) |
Flächenverhältnis %RSD bei 5 µg/l Lösung (n=8) |
Flächenverhältnis %RSD bei 5 µg/l Lösung (n=72) |
|
Benzo[c]fluoren |
0,327 |
1,090 |
6,2 |
1,5 |
2,2 |
|
Benzo[a]anthracen |
0,176 |
0,588 |
5,3 |
1,6 |
2,4 |
|
Cyclopenta[c,d]pyren |
0,157 |
0,522 |
3,1 |
1,5 |
4,2 |
|
Chrysen |
0,175 |
0,583 |
5,9 |
2,0 |
3,2 |
|
5-Methylchrysen |
0,112 |
0,373 |
2,8 |
1,6 |
2,4 |
|
Benzo[b]fluoranthen |
0,088 |
0,293 |
3,0 |
1,8 |
2,7 |
|
Benzo[j]fluoranthen |
0,077 |
0,256 |
5,2 |
4,1 |
4,3 |
|
Benzo[k]fluoranthen |
0,077 |
0,255 |
5,1 |
3,9 |
4,8 |
|
Benzo[a]pyren |
0,071 |
0,236 |
4,0 |
2,1 |
2,8 |
|
Indeno[1,2,3-cd]pyren |
0,049 |
0,163 |
1,4 |
2,2 |
2,3 |
|
Dibenzo[a,h]anthracen |
0,045 |
0,150 |
1,9 |
1,7 |
2,6 |
|
Benzo[g,h,i]perylen |
0,038 |
0,127 |
2,7 |
2,2 |
2,5 |
|
Dibenzo[a,l]pyren |
0,107 |
0,358 |
7,3 |
3,4 |
4,4 |
|
Dibenzo[a,e]pyren |
0,127 |
0,423 |
7,2 |
2,4 |
3,7 |
|
Dibenzo[a,i]pyren |
0,114 |
0,378 |
5,3 |
3,0 |
7,9 |
|
Dibenzo[a,h]pyren |
0,137 |
0,458 |
5,3 |
3,0 |
4,3 |
Ein attraktives neues Verfahren
Mithilfe des GCMS-TQ8050 NX konnte ein MRM-Verfahren für die Analyse polyzyklischer aromatischer Kohlenwasserstoffe in Palmöl entwickelt werden, das auch für die Untersuchung anderer Öle und Fette geeignet ist. Die Ergebnisse zeigen, dass sich die 15+1 PAK mit dieser Methode selbst in geringer Konzentration nachweisen und quantifizieren lassen – bis zu einer Nachweis- und Bestimmungsgrenze von 0,071 µg/kg (LOD) bzw. 0,127 µg/kg (LOQ). Eine ausgezeichnete Linearität der IS-Kalibrierkurven mit R2-Werten wurde ebenfalls erzielt. Neben einer hohen Empfindlichkeit und Selektivität bietet das optimierte MRM-Verfahren schließlich auch eine gute Wiederholbarkeit und Stabilität, was die neue Methode für den analytischen Einsatz in Laboren attraktiv macht.