Metallfrei zu besseren Ergebnissen – inerte LC-Säulen
Neue Lösung für die Analyse von kritischen Komponenten
Dr. Martin Meyer, Shimadzu Europa GmbH
Die steigenden Anforderungen bei der Analyse von biologischem Material, insbesondere in der medizinischen Forschung, haben dazu geführt, dass in den vergangenen Jahren immer mehr Säulen für die Flüssigchromatographie (LC-Säulen) als bioinert vermarktet werden. Das Hauptziel besteht darin, die Metallwechselwirkung zwischen dem Zielmolekül und der Säulenhardware zu verringern. Dies soll zu einer besseren Sensitivität und Reproduzierbarkeit führen. Dieser Artikel beschreibt das Prinzip der Adsorption, wie inerte Säulen diese verhindern können und welche Lösungen Shimadzu anbietet.
Eine große Zahl von LC-Säulen-Anbietern, die inerte Säulen in ihr Portfolio aufgenommen haben, wirbt damit, dass es keine Wechselwirkungen zwischen dem Metall der Säule und den Analyten gibt und somit Analyseergebnisse präziser werden. Im Vergleich dazu sind bei Standard-Edelstahlsäulen Wechselwirkungen zwischen Säulenmetall und Analyten möglich. Der Unterschied zwischen Standard- und bioinerter Säule kann je nach Analyten deutlich sein (Abbildung 1).
Die Prozesse, die zu Adsorptionseffekten am Metall der Säule führen, können in zwei Phänomene unterschieden werden. Zum einen das Herauslösen von Metallionen aus der Säule oder dem System, die sich dann z. B. auf der stationären Phase ablagern und dort zu ionischen Wechselwirkungen führen können. Der zweite Effekt ist die koordinierende Wirkung der positiven Metalloberfläche auf elektronenreiche Analyten. Beide Effekte haben zur Folge, dass ein Teil bestimmter Analyten länger auf der Säule verbleibt oder sich überhaupt nicht von der Säule löst. Dies führt zu Sensitivitätsverlusten oder einer Verschlechterung der Peakform.
Betroffen sind unter anderem Moleküle, die Phosphatgruppen tragen, wie Oligonukleotide und Phosphopeptide. Aber auch Tetracycline und Mykotoxine und andere Moleküle können deutlich unter den Folgen der Metallwechselwirkung leiden.[1, 2] Darüber hinaus können Proteine und Peptide während der Trennung anfällig für metallionenkatalysierte Zersetzung sein, die ebenfalls durch die Verwendung von bionierten Säulen verhindert wird.[3]

|
Methode |
Nachteil |
|
Oberflächenpassivierung mit Säuren |
Zeitlich begrenzt |
|
Oberflächenpassivierung mit Probe oder Matrix |
Nicht stabil |
|
Chelatbildner in der mobilen Phase |
Ionenunterdrückung |
|
Andere Metalle wie Titaninium und MP35N (eine Nickel-Kobalt-Legierung) |
Wechselwirkung/Auswaschung von Metallen noch möglich |
|
Reine PEEK-Säulen |
geringe Druckstabilität |
|
Glas verkleidet |
Fritte aus anderem Material -> PEEK oder Beschichtung |
|
PEEK ausgekleidet |
Begrenzte Lösemittelverträglichkeit |
|
Beschichtungen |
– |
Die Auswirkungen von Metallen auf die Chromatographie sind bereits seit mehr als 20 Jahren bekannt.[4] Um die Probleme der Metallwechselwirkungen zu lösen, wurden bisher verschiedene Methoden angewandt (Tabelle 1).
Es gibt eine Reihe von temporären Lösungen wie die Passivierung mit Säure oder mit der Probe selbst, aber diese Passivierungen müssen nach einiger Zeit erneuert werden und machen die Methode selbst weniger robust. Alternative Lösungen, wie die Verwendung anderer Metalle als Stahl, können einige der Adsorptionseffekte verringern, aber letztendlich wird immer noch Metall verwendet, das weiterhin Wechselwirkungen verursachen kann.
Die beiden am häufigsten von Säulenherstellern verwendeten Techniken für inerte Säulen sind die Auskleidung der Metallsäule mit einer Polyetheretherketon(PEEK)-Polymerschicht und die Beschichtung der Metalloberfläche der Säule. Shimadzu bietet beide Varianten an: die beschichteten Säulen unter dem Namen Shim-pack Scepter Claris (kurz „CL“) und die PEEK-lined-Säulen mit dem Zusatz „Metal free“ oder kurz MF. Der Vorteil dieser Kombination ist, dass die Säulen nicht mit metallempfindlichen Analyten interagieren, aber dennoch die Hochdruckstabilität typischer Metallsäulen für die Flüssigchromatographie bieten.
Auswirkungen inerter Komponenten
Die Phänomene, die zur Adsorption führen, sind in Abbildung 2 dargestellt, ebenso wie die Verwendung von inertem Säulenmaterial zur Vermeidung von Wechselwirkungen. Um die Auswirkungen dieser inerten Komponenten zu untersuchen, wurde die Anwendbarkeit des inerten Shimadzu Nexera XS Systems und der metallfreien Shim-pack Scepter Säulen für die Analyse von Nukleotiden und Phosphopeptiden getestet. Beide Substanzen sind für die medizinische Forschung von Bedeutung. So sind Oligonukleotide unter anderem wichtig für die Behandlung seltener Krankheiten [5] und anhand von Phosphopeptiden können neue Erkenntnisse in der Krebsforschung gewonnen werden.
Die detaillierten Analysebedingungen für Nukleotide und Phosphopeptide sind in Tabelle 2 aufgeführt. Bei der Probenvorbereitung ist darauf zu achten, dass für die Lagerung der Proben keine Standard-Glasvials verwendet werden, da auch diese Metalle an der Glasoberfläche aufweisen und es zu Adsorptionen kommen kann. Daher wird die Verwendung von Vials mit geringer Adsorption wie TORAST-H Vials von Shimadzu empfohlen. Für alle Untersuchungen wurde das Nexera XS Inert System verwendet, bei dem der gesamte Flussweg inert ausgekleidet ist. Damit ist das System ideal auf die inerte Säulenhardware abgestimmt.
|
Analyt |
Nukleotide |
Phosphopeptide |
||||||||||||||||
|
System |
Nexera XS inert |
Nexera XS inert |
||||||||||||||||
|
Säule |
Shim-pack Scepter C18 (metallfrei) |
Shim-pack Scepter C18 |
||||||||||||||||
|
Mobile Phase |
Acetonitril/Wasser + 50 mmol Ammoniumformiat = 0,5:99,5 |
A) Wasser + 0,1 % Ameisensäure |
||||||||||||||||
|
Gradient |
Isokratisch |
B konz. 5 % (0 min) → 50 % (12–13 min) → 5 % (13,01–16 min) |
||||||||||||||||
|
Flussrate |
0,2 ml/min |
0,3 ml/min |
||||||||||||||||
|
Injektions-volumen |
2 µL |
1 µL |
||||||||||||||||
|
Ofentemperatur |
40 °C |
40 °C |
||||||||||||||||
|
Probe |
Äquimolare (50 µg/mL) Mischung aus Adenosintriphosphat, Adenosindiphosphat and Adenosinemonophosphat, gelöst in reinem Wasser |
MS PhosphoMix 2 Light (40 nmol/l) |
||||||||||||||||
|
Vial |
TORAST-H Vial (low-adsorption Glas-Vials) |
TORAST-H Bio Vial (PP-Vials) |
||||||||||||||||
|
Detektor |
PDA (254 nm) |
LCMS-8045 |
||||||||||||||||
|
Detektor-einstellungen |
PDA-Zelle: Standard (inert für Nexera XSi) |
|
Ergebnisse
Nukleotide
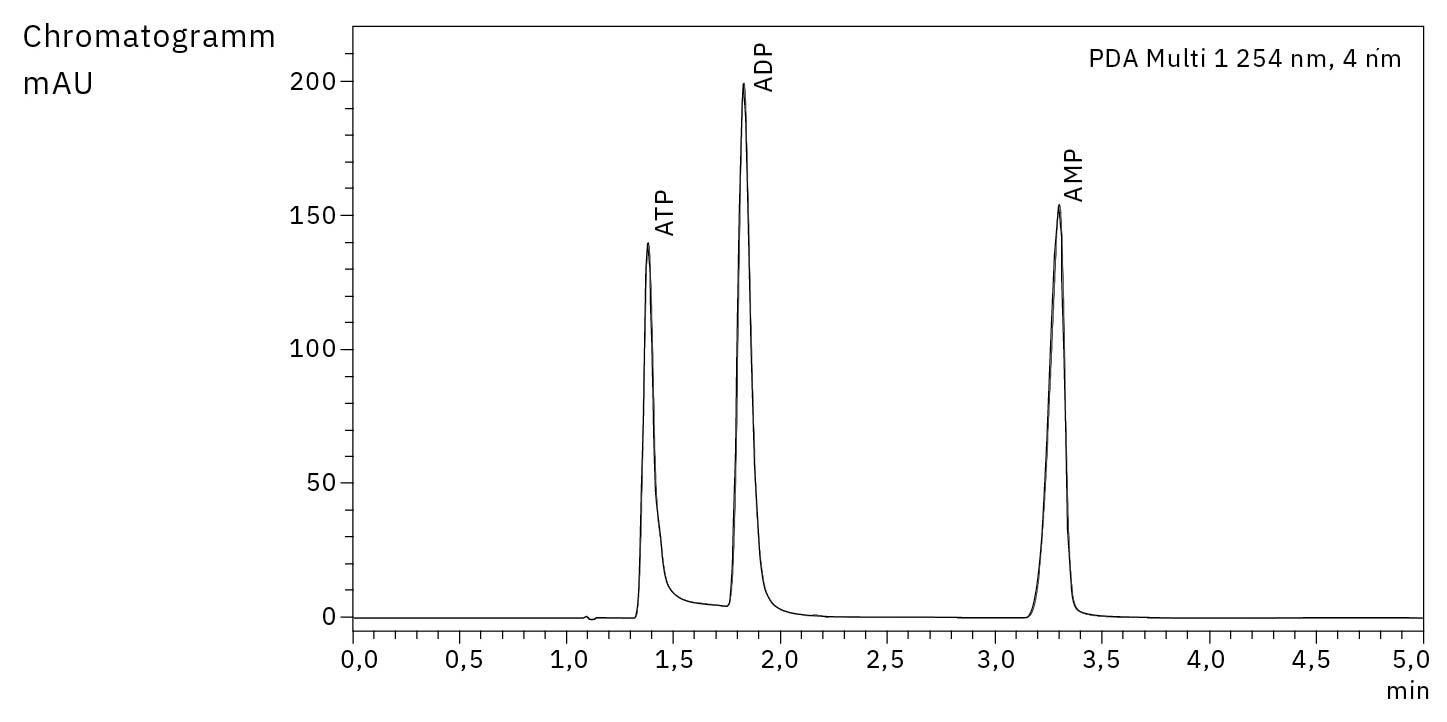
Die Adsorption von Metallen lässt sich durch eine schlechte Wiederfindung und eine starke Peakverbreiterung der adsorbierten Komponenten aufgrund einer verstärkten Wechselwirkung erkennen. Tatsächlich sind die Peakformen und die Empfindlichkeit von Adenosintriphosphat (ATP) und Adenosindiphosphat (ADP) schlecht, wenn eine konventionelle Säule mit einem Standard-UHPLC-System kombiniert wird. Die Verwendung einer inerten Säule und eines inerten Systems liefert die besten Ergebnisse mit sehr symmetrischen Peakformen und der höchsten Signalintensität (Abbildung 1).
Ein wichtiger Faktor, der insbesondere bei der Arbeit mit konventionellen Säulen und Systemen berücksichtigt werden muss, ist die Tatsache, dass die Anzahl der Injektionen einen Einfluss auf die Empfindlichkeit und die Peakform hat. Grund dafür ist, dass der Analyt mit zunehmender Anzahl von Injektionen eine Passivierungsschicht auf der Metalloberfläche bildet. Dies wird in Abbildung 3 veranschaulicht, in der der Tailing-Faktor in Abhängigkeit von der Anzahl der Injektionen dargestellt ist. Werte, die sich im Verlauf der Injektionen stark ändern, weisen auf eine schlechte Reproduzierbarkeit hin. Einige Anwender nutzen absichtlich die Passivierungswirkung der Probe oder anderer Substanzen, um ihr System zu konditionieren, aber diese Passivierungsschicht ist nicht dauerhaft und wird mit der Zeit abgebaut. Daher bietet der vollständig inerte Aufbau die besten Bedingungen für die analysierten Nukleotide.

Phosphopeptide
Die Standardsäule mit Metallmaterial zeigte bei der Analyse des Phosphopeptidgemischs eine schlechte Leistung. Mehrere Verbindungen waren nicht nachweisbar und die vorhandenen Verbindungen wiesen kleine, breite Peaks auf. Durch die Verwendung der Bioinert-Säulen wurde eine deutliche Leistungssteigerung erzielt. Es konnten nicht nur alle in der Standardmischung vorhandenen Verbindungen nachgewiesen werden, sondern dies geschah auch mit einer um mindestens 50 % höheren Empfindlichkeit im Vergleich zur nicht inerten Säule (Abbildung 4). Darüber hinaus beeinflusst die Menge oder Position der Phosphatgruppe den Grad der Adsorption. So können einige Verbindungen auch auf der Metallsäule nachgewiesen werden, während andere Verbindungen überhaupt nicht mehr nachweisbar sind.
Mehr Empfindlichkeit in der Analyse
Die Verwendung metallfreier Komponenten sowohl im LC-Gerät als auch in der LC-Säule hat die Empfindlichkeit der Nukleotid-Analyse erheblich verbessert. Außerdem ist die Reproduzierbarkeit im Vergleich zu herkömmlichen Systemen besser. Alle Phosphopeptidkomponenten konnten mit den beschichteten und mit PEEK ausgekleideten Säulen nachgewiesen werden. Im Vergleich dazu wurden bei Verwendung einer Metallsäule einige Verbindungen so stark adsorbiert, dass sie nicht mehr nachweisbar waren. Die Empfindlichkeit der beiden bioinert modifizierten Säulen war ähnlich, sodass beide Säulen von Shimadzu eine sehr gute Option für die Analyse von Phosphopeptiden darstellen.
[1] D’Atri, V., Murisier, A., Fekete, S., Veuthey, J.L., Guillarme, D., Current and future trends in reversed-phase liquid chromatography-mass spectrometry of therapeutic proteins, TrAC Trends in Analytical Chemistry, Vol. 130, 2020.
[2] Anspach, J.A., Rao, S., Rivera, B., Bioinert versus biocompatible: the benefits of different column materials in liquid chromatography separations, LCGC North Am., Vol. 36, 2018, pp. 24–29.
[3] Zang, L., Carlage, T., Murphy, D., Frenkel, R., Bryngelson, P., Madsen, M., Lyubarskaya, Y., Residual metals cause variability in methionine oxidation measurements in protein pharmaceuticals using LC-UV/MS peptide mapping, Vol. 895–896, 2012, pp. 71–76.
[4] Euerby, M.R., Johnson, C.M., Rushin, I.D., Sakunthala Tennekoon, D.A.S., Investigations into the Epimerisation of Tipredane Ethylsulphoxide Diastereoisomers during Chromatographic Analysis on Reversed-Phase Silica II. The Involvement of Metals in Commercially Available C18 Silicas, J. Chromatogr., Vol. 705 (2), 1995, pp. 229–245.
[5] Schad, G., Erxleben B.T., Improving biopharmaceutical drug development, Secrets of Science 1/2023, https://www.shimadzu-webapp.eu/magazine/issue-2023-01_en/improving-biopharmaceutical-drug-development/.