Warum altern Akkus?
GC-MS-Analyse von Fluorophosphaten als potenzielle Frühindikatoren für geminderte Akku-Qualität
Dr. Waldemar Weber, Shimadzu Europa GmbH
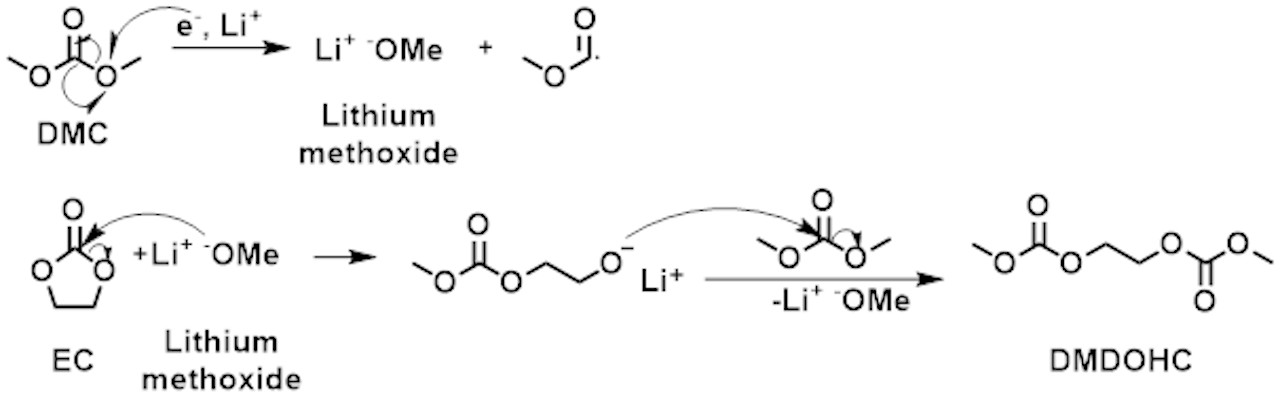
Die Alterung von Akkus ist vorwiegend auf die Zersetzung der Elektrolytlösung zurückzuführen, den wesentlichen Hauptteil eines herkömmlichen Lithium-Ionen-Akkus. Dieser besteht aus Li-Ionen-Salz (z. B. LiPF6), organischen Carbonaten und Additiven, die einen stabilen Transport der Li-Ionen während des Lade- und Entladevorgangs gewährleisten. Am Ende dieser chemischen und elektrochemischen Prozesse konnten oligomere organische Verbindungen (Abbildung 1) [1] und Organophosphate [2, 3] nachgewiesen werden.

Insbesondere fluorhaltige Organophosphate sind aufgrund ihrer potenziellen Neurotoxizität von Bedeutung [4, 5, 6]. Obwohl die elektrochemische Alterung im Akku selbst abläuft, beginnt die chemische Alterung bereits bei der Herstellung, der Lagerung und dem Transport des Elektrolyten. Zu den typischen Einflussfaktoren zählen Luft und Feuchtigkeit, zu hohe Temperaturen während der Herstellung/Aufbewahrung und die Langzeitlagerung im Allgemeinen. Ungeeignete Materialien in der Produktionskette (z. B. Glas) sind ebenfalls problematisch, da Spuren von Fluorsäure katalytisch mit SiO2 reagieren: SiO2 + 6HF → H2[SiF6] + 2H2O. Diese Analyse einer Elektrolytlösung dient der qualitativen Kontrolle und Bestimmung von Fluorophosphaten.
Probenvorbereitung und -messung
25 µl des Elektrolyts eines Lithium-Ionen-Akkus, bestehend aus Ethylmethylcarbonat und Ethylencarbonat (1:1) mit 1M LiPF6, wurden mit 1 ml Dichlormethan verdünnt und 5 Minuten lang bei 8.500 U/min zentrifugiert, um das feste LiPF6 abzutrennen. Die zentrifugierte Lösung wurde in ein 2-ml-GC-Glasfläschchen umgefüllt und bis zur Messung mit einem GCMS-QP2020 NX bei 7 °C gelagert (Abbildung 2).
Angaben zur Methode
Die analytischen GC-MS-Bedingungen sind im Detail in Tabelle 1 aufgeführt.
| Systemkonfiguration | ||
|---|---|---|
| Modell | GCMS-QP2020 NX | |
| Autosampler | AOC-30i | |
| GC-Parameter | Injektionsmodus | Splitlos |
| Säule | SH-I-5MS (30 m x 0,25 mm x 0,25 µm; Teile-Nr. 221-75940-30) | |
| Lin. Geschwindigkeit | 36,8 cm/s | |
| GC-Ofenmethode | 35 °C für 1 min, 3 °C/min bis 60 °C, 30 °C/min bis 210 °C, 210 °C für 1 min | |
| Temperatur der Transferleitung | 210 °C | |
| Trägergas | He | |
| MS-Parameter | Ionenquellen-Temperatur | 180 °C |
| Ionisationsmodus | EI | |
| Messmodus | SIM/Scan | |
| Schnittzeit für Lösungsmittel | 2 min | |
Zersetzungsmechanismus des Lithium-Ionen-Akku-Elektrolyten
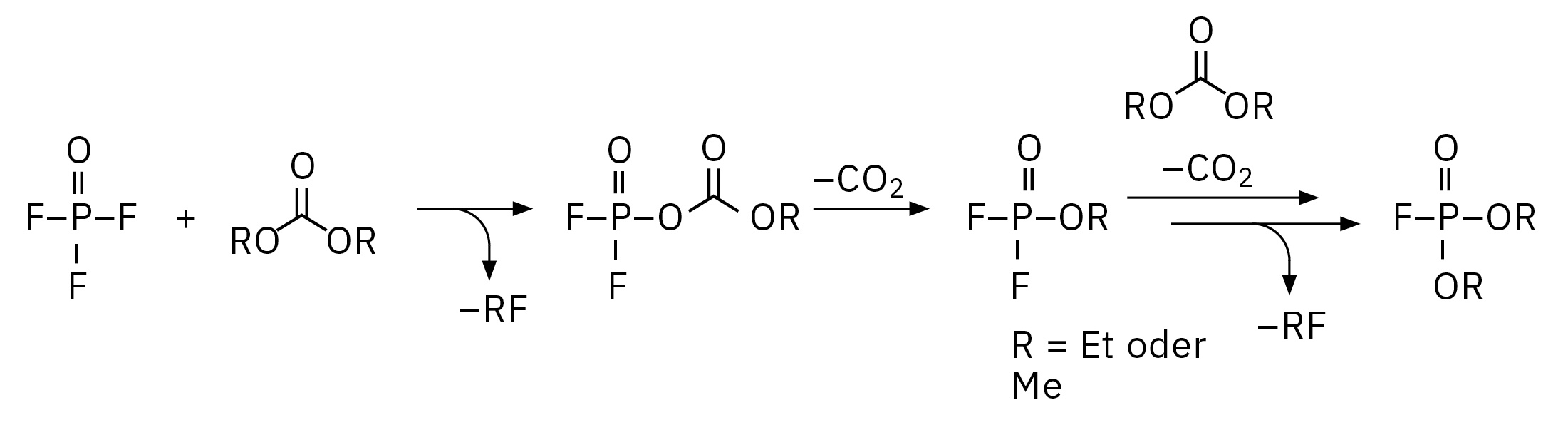
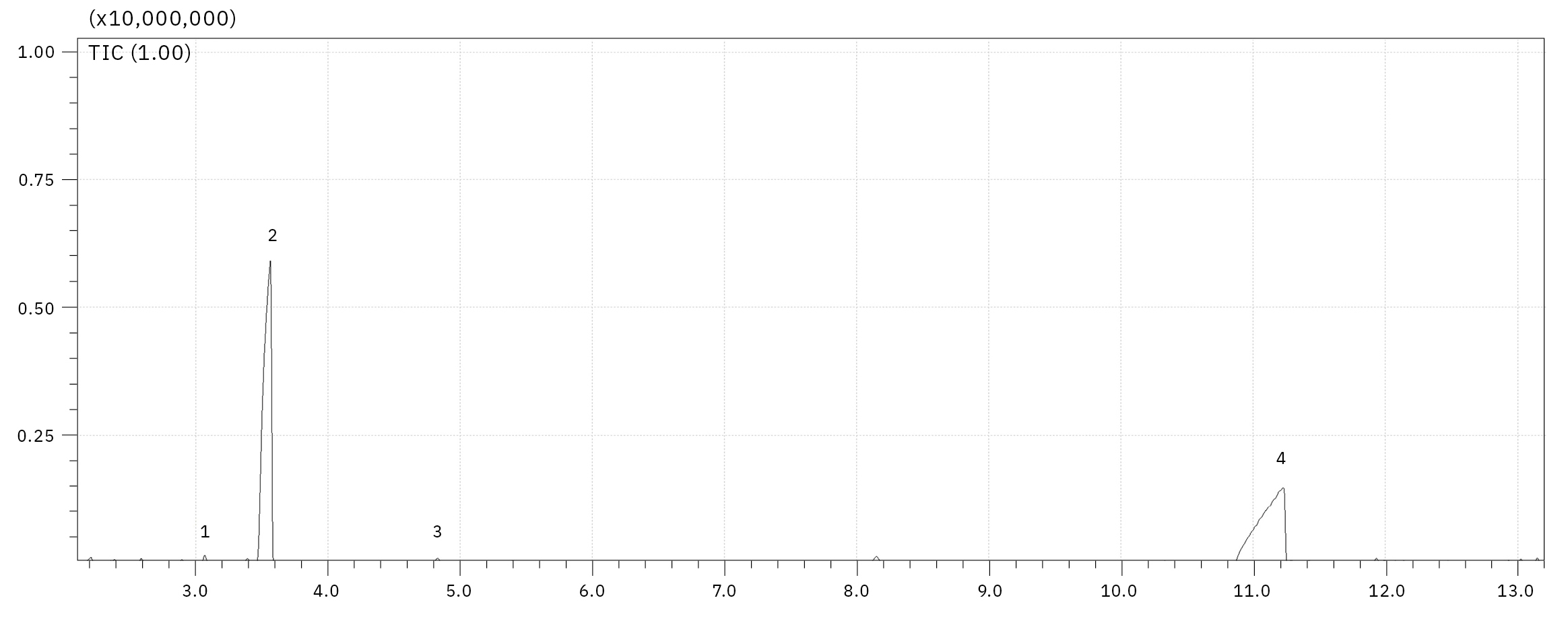
Der für dieses Experiment verwendete Elektrolyt wurde etwa ein Jahr lang bei -30 °C in einem Kühlschrank gelagert. Jegliche Alterungsprozesse sollten unter solchen Bedingungen extrem verlangsamt sein. Dennoch hat eine so lange Lagerung bereits einen Einfluss auf die Zersetzung, wie in Abbildung 4 dargestellt. Eine chemische Umlagerung von Ethylmethylcarbonat (EMC, 2) zu Dimethylcarbonat (DMC, 1) und Diethylcarbonat (DEC, 3) wurde beobachtet. Die Zersetzung von LiPF6-Salz bei der Reaktion mit Spuren von Wasser und dem entsprechenden Elektrolytlösungsmittel kann durch elektrochemische und chemische Prozesse beeinflusst werden. Die Reaktionsmechanismen sind im Grunde identisch, wobei der Gehalt der entstehenden Organophosphate stark vom Alterungsstadium des Elektrolyten/Lithium-Ionen-Akkus abhängt.[2, 3] Bei dem gelösten LiPF6-Salz gilt ein thermodynamisches Gleichgewicht LiPF6 ↔ LiF + PF5 als Ausgangspunkt für die Zersetzung, wobei das PF5 bei der Reaktion mit Spuren von Wasser POF3 bildet, gefolgt von einer Kette von Reaktionen von POF3 mit organischen Carbonat-Lösungsmitteln. Die exakten Reaktionsmechanismen werden derzeit intensiv erforscht. Einer der möglichen Mechanismen der Zersetzung von POF3 in Fluorophosphate ist in Abbildung 3 dargestellt. Der Zersetzungsprozess lässt sich in vier Schritte unterteilen: 1. Bildung von POF3, 2. Bildung von Difluorophosphat, 3. Bildung von Monofluorophosphaten, 4. Bildung von Trialkylphosphaten.
Einfache und zuverlässige Ermittlungsmethode für frühe Anzeichen von Zersetzung mittels Flüssigkeitsinjektion für GC-MS
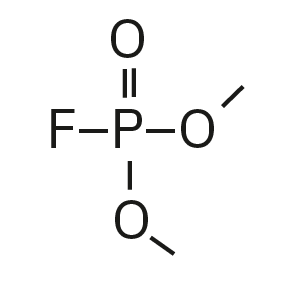
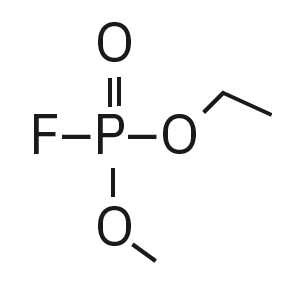
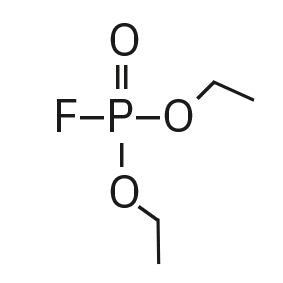
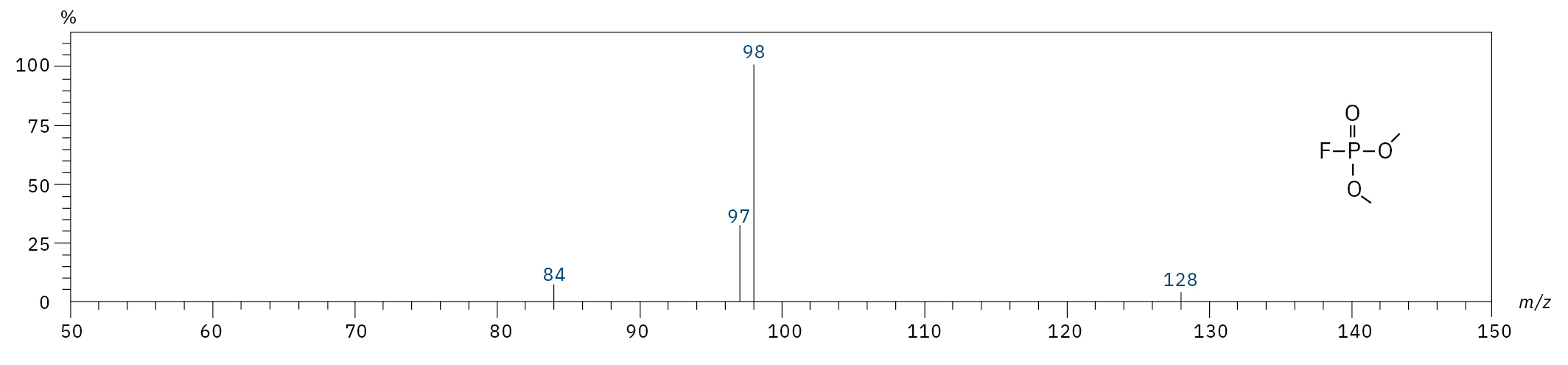
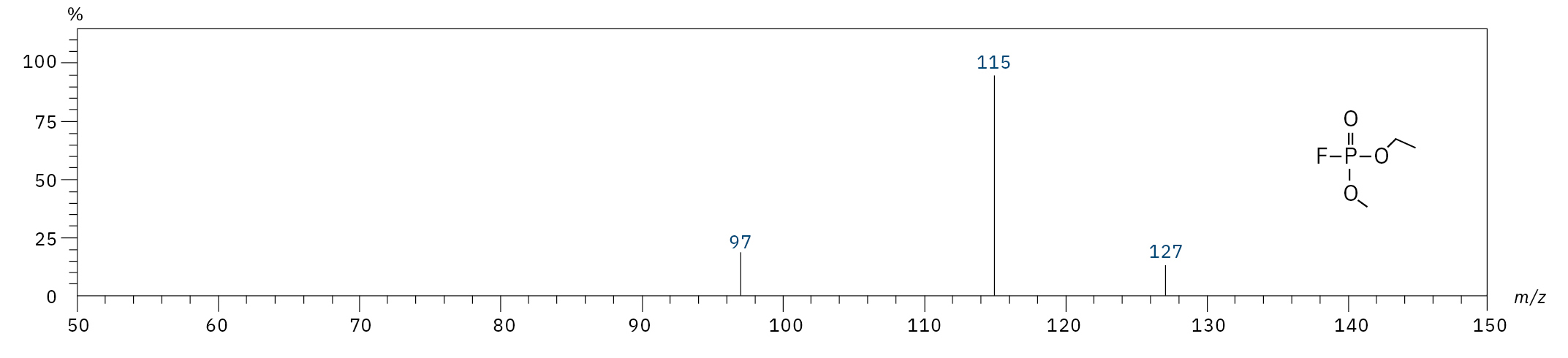
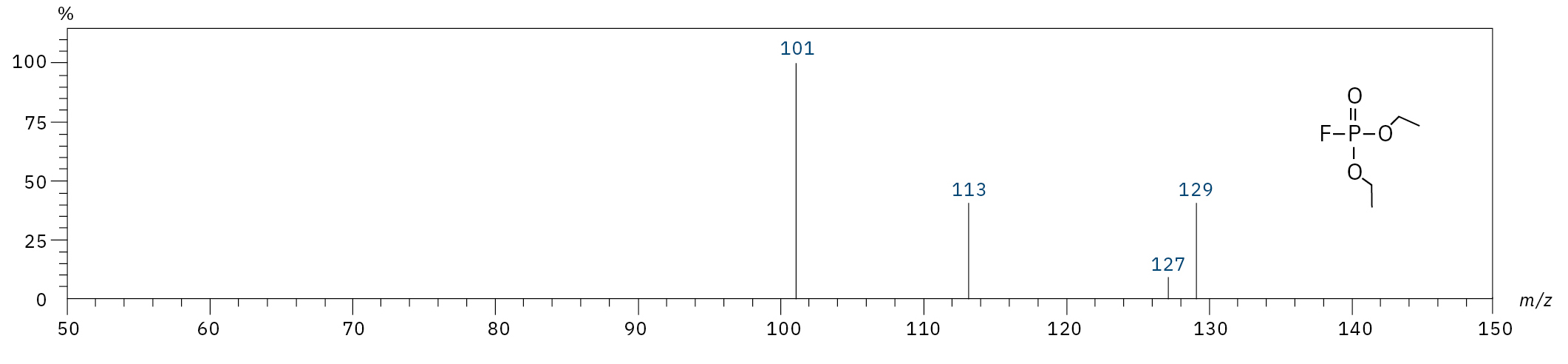
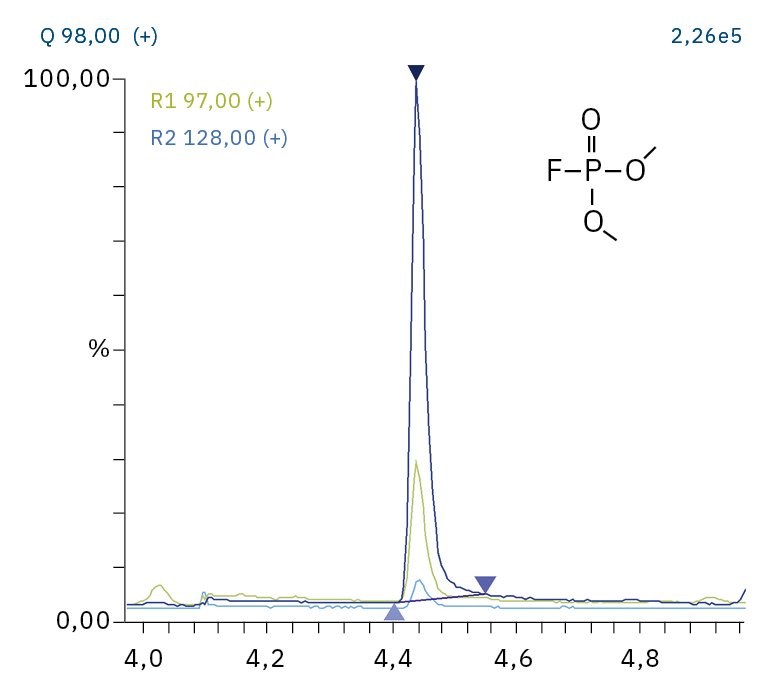
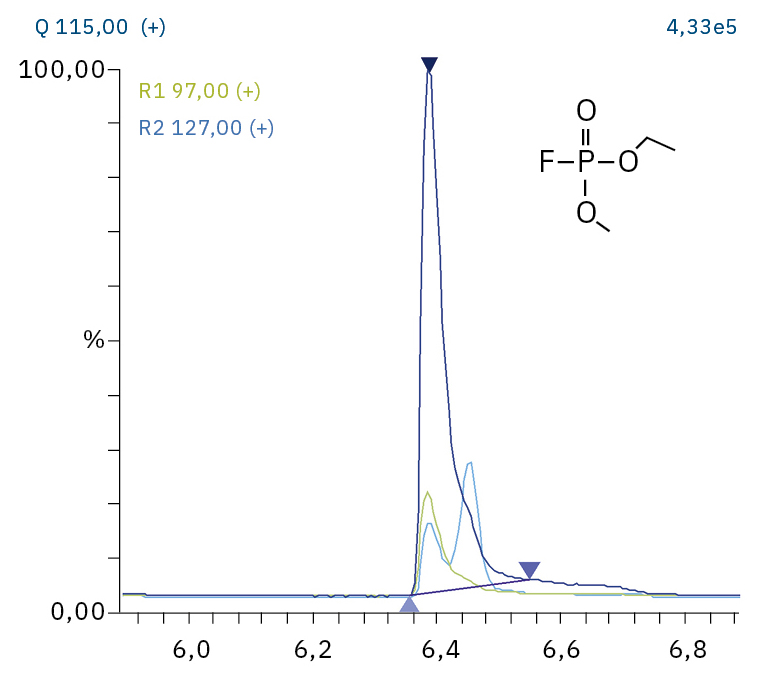
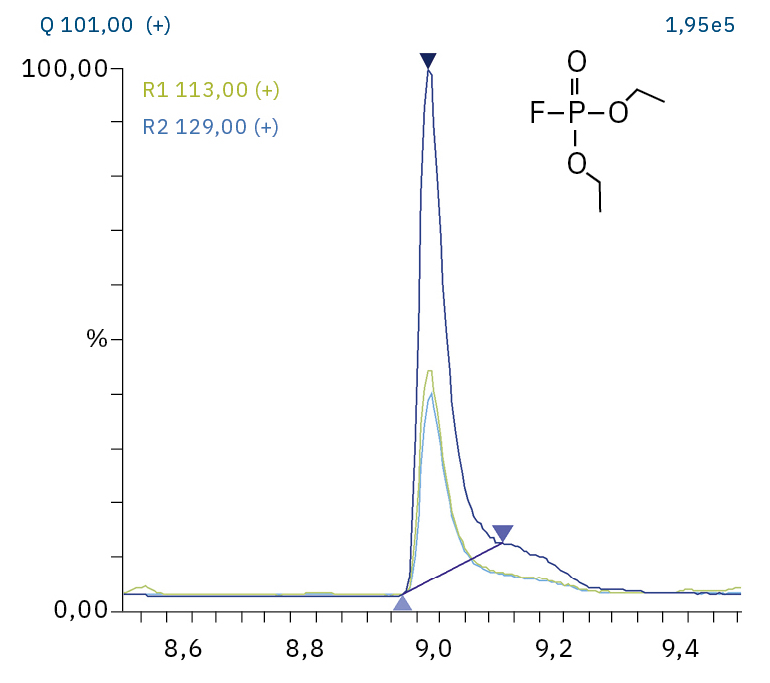
Für die Analyse der leicht flüchtigen Zersetzungsprodukte in Schritt 1 und 2 ist aufgrund einer Reaktion mit dem Lösungsmittel eine Headspace-basierte Injektion für GC-MS erforderlich. Die hier verwendete flüssigkeitsbasierte Injektion ermöglicht die Analyse der Produkte in Schritt 3 und 4. Der verwendete Elektrolyt besteht aus Ethylmethylcarbonat, weshalb methylierte, ethylierte und gemischte Ethylmethylphosphatarten zu erwarten sind. Ein SCAN-/SIM-Modus für den Nachweis ermöglicht eine eindeutige Identifizierung von Verbindungen anhand eines Massenspektrums und einen empfindlichen und selektiven Nachweis anhand von SIM-Spuren. Die verwendeten m/z-Werte für den SIM-Nachweis sind in Tabelle 2 aufgeführt. Bei dem analysierten Elektrolyten konnten nur dialkylierte Spezies nachgewiesen werden (Tabelle 2), jedoch keine trialkylierten. Grund dafür ist eine Zersetzung in einem sehr frühen Stadium, da nur ein langfristig gelagerter Elektrolyt verwendet wurde, bei dem die Bildung von trialkylierten Spezies noch nicht eingesetzt hat. Das ermittelte Massenspektrum ist in Abbildung 5 und die entsprechenden Chromatogramme sind in Abbildung 6 dargestellt. Das allgemeine Problem bei der Identifizierung solcher Verbindungen ist der Mangel an M+-Spitzen in den Spektren (außer DMFP) und ihre Abwesenheit in herkömmlichen GC-MS-Bibliotheken (außer DEFP). Zur Identifizierung des Spektrums verwendeten die Forscher synthetische Standards und für kompliziertere Spezies zusätzlich NCI mit CI-GC-MS-Nachweisen.[3]
Verbindung |
Chemische Struktur |
m-z für SIM |
Ret.-Zeit [min] |
Dimethylfluorophosphat (DMFP) |
|
97, 98, 128 |
4,44 |
Ethylmethylfluorophosphat (EMFP) |
|
97, 115, 127, 141 |
6,3 |
Diethylfluorophosphat (DEFP) |
|
101, 113, 129 |
9,0 |
Das Ziel: eine längere Akkulaufzeit
Elektrolyte von Lithium-Ionen-Akkus auf LiPF6-Basis zersetzen sich durch chemische und elektrochemische Prozesse. Mithilfe der GC-MS-basierten Analysemethode gelang eine eindeutige Identifizierung von drei fluorierten Alkylphosphaten in einem langzeitgelagerten Elektrolyten. Das macht das GCMS-QP2020 NX zu einer zuverlässigen und einfachen Analysemöglichkeit selbst in frühen Stadien der Elektrolytzersetzung und ermöglicht so eine vorhersehbarere und nachhaltigere Gestaltung der Lebensdauer von Akkus.
[1] X. Mönnighoff, Investigation of Lithium Ion Battery Electrolytes with Gas Chromatography after Recovery by Supercritical Fluid Extraction, PhD Thesis, University of Münster, 2020.
[2] Waldemar Weber, Ralf Wagner, Benjamin Streipert, Vadim Kraft, Martin Winter, Sascha Nowak, Journal of Power Sources, 2016, 306, 193–199.
[3] Waldemar Weber, Vadim Kraft, Martin Grützke, Ralf Wagner, Martin Winter, Sascha Nowak, 2015, 1394, 128–136.
[4] K. Husain, Delayed neurotoxicity of organophosphorus compounds, J. Environ. Immunol. Toxicol. 1 (2013), 14–21.
[5] L.D. Karalliedde, P. Edwards, T.C. Marrs, Variables influencing the toxic response to organophosphates in humans, Food Chem. Toxicol. 41 (2003), 1–13.
[6] A. Ordentlich, D. Barak, C. Kronman, N. Ariel, Y. Segall, B. Velan, A. Shafferman, The architecture of human acetylcholinesterase active center probed by interactions with selected organophosphate inhibitors, J. Biol. Chem. 271 (1996), 11953–11962.