Massen-spektrometrischer Nachweis von Alzheimer-Biomarkern im Blut
Mit nur wenigen Tropfen Blut – der erste erfolgreiche Nachweis von Plasma-Aβ mittels Massenspektrometrie
Dr. Naoki Kaneko, Shimadzu Corporation
Eine Akkumulation von Amyloid β (Aβ) im Gehirn gilt als erstes Anzeichen für die Pathologie der Alzheimer-Krankheit. Neu entwickelte krankheitsmodifizierende Therapien richten sich an Patienten im Frühstadium der Alzheimer-Krankheit. Daher werden Biomarker im Blut für den Nachweis der Aβ-Akkumulation benötigt. Durch die Kombination von Immunpräzipitation (IP) und Massenspektrometrie (MS) haben wir eine IP-MS-Methode entwickelt, die erstmals den erfolgreichen Nachweis von Plasma-Aβ mittels Massenspektrometrie ermöglichte. Die Anwendung dieser Methode ergab eine hohe Konkordanz zwischen einem zusammengesetzten Biomarker aus zwei Plasma-Aβ-Verhältnissen und dem Amyloid-PET-Status. Angesichts der zunehmenden Fortschritte im Bereich der krankheitsmodifizierenden Therapien gewinnen blutbasierte Biomarker zunehmend an Bedeutung, da sie eine Schlüsselrolle bei der Voruntersuchung von Patienten, der Überwachung der Arzneimittelwirkungen und der Diagnose spielen.
Plasma-Amyloid-β-Biomarker-Assay – ein Frühwarnsystem für die Diagnose von Alzheimer
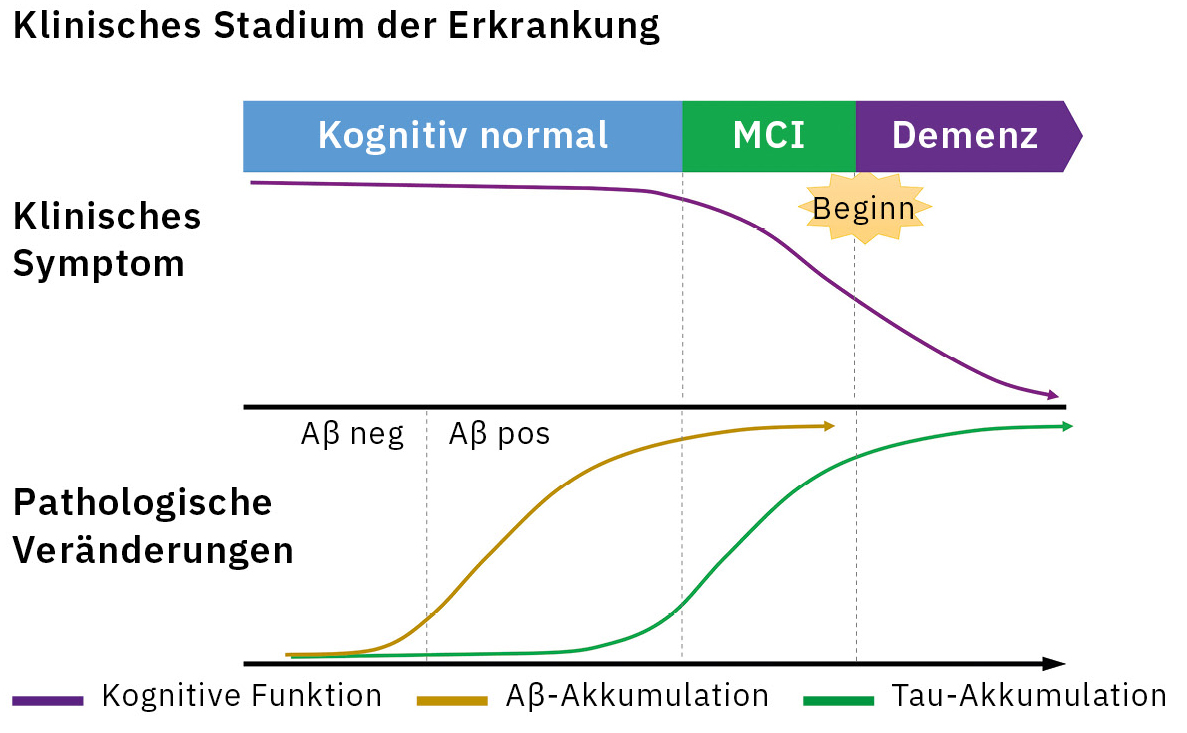
Die Alzheimer-Krankheit ist mit 60 bis 70 % aller Fälle die Hauptursache für Demenz. Eine Akkumulation von Amyloid β (Aβ) im Gehirn gilt als erstes Anzeichen im Kontinuum der pathologischen Veränderungen der Alzheimer-Krankheit und setzt 20 bis 30 Jahre vor dem Auftreten der Symptome ein (Abbildung 1).[1] Daher spielt ein Biomarker, der die Pathologie der Erkrankung widerspiegelt, eine Schlüsselrolle bei der Frühdiagnose der Alzheimer-Krankheit. Bisher wurden als Nachweismethoden für Aβ-Biomarker die Amyloid-Positronen-Emissions-Tomographie (PET) und der Immunassay für Aβ1-42 und Aβ1-42/1-40 im Liquor eingesetzt.
Allerdings sind für die Amyloid-PET eine umfangreiche PET-Ausrüstung und ein hoher Kostenaufwand erforderlich, wobei die Entnahme von Liquor-Aβ durchaus invasiv ist. Daher bestand ein Bedarf an einem blutbasierten Biomarker, der sich leicht messen lässt. Im Laufe der vergangenen Jahre zeigte sich der klinische Nutzen von Plasmabiomarkern mit den bedeutenden technologischen Fortschritten bei der Messung von Plasmabiomarkern. Zu den wichtigsten Technologien zur Messung von Plasma-Aβ gehören die Immunpräzipitation in Kombination mit Massenspektrometrie (IP-MS) und einem Sandwich-Immunassay mit zwei Arten von Antikörpern. In einer direkten Vergleichsstudie von Plasma-Aβ-Tests wurde eine höhere Genauigkeit der IP-MS als des Immunassays festgestellt.[2, 3, 4]
Im folgenden Abschnitt werden die Amyloid-MS-Technik unter Verwendung der IP-MS-Methode mit matrix-assistierter Laser-Desorptions-Ionisierungs-Flugzeitmassenspektrometrie
(MALDI-TOF-MS) und die hohe Leistungsfähigkeit von Plasma-Aβ-Biomarkern in klinischen Studien beleuchtet.
Amyloid-Massenspektrometrie: IP-MS-Methode unter Verwendung eines MALDI-TOF-Massenspektrometers
Immunassays werden seit 1996 in der Forschung zu Aβ-Biomarkern im Plasma eingesetzt. Zahlreiche Studien zu Plasma-Aβ als Biomarker lieferten jedoch widersprüchliche Ergebnisse über den Status von Plasma-Aβ aufgrund seiner analytischen Komplexität, weshalb sein Nutzen viele Jahre lang mit Skepsis betrachtet wurde.[5] Mittels Massenspektrometrie lassen sich verschiedene Peptide nachweisen, die mit hoher Empfindlichkeit ihrer Masse entsprechend getrennt werden. Auf diese Weise können mit der Massenspektrometrie sogar ähnliche Peptide wie Aβ1-38, Aβ1-40, Aβ1-42 usw. genau und gleichzeitig nachgewiesen werden. Wenn eine Probe jedoch große Mengen an Verunreinigungen enthält, überlagert das starke Signal dieser Verunreinigungen das schwache Signal der nur in geringen Mengen vorhandenen Analyten. Blutplasmaproben enthalten in der Regel erhebliche Mengen an Verunreinigungen. Deshalb war es bisher nicht möglich, mittels Massenspektrometrie Biomarker in Plasmaproben mit hoher Empfindlichkeit zu messen.
Durch die Einführung eines auf Antikörpern basierenden Schrittes der Immunpräzipitation (IP) in die Probenvorbereitung gelang ein entscheidender Durchbruch: die selektive Abtrennung und Aufkonzentrierung von Aβ. Eine IP-MS-Methode zum Nachweis von Aβ wurde bereits 1996 beschrieben, mit der Aβ in Proben von Zellkulturüberständen und Liquor leicht nachgewiesen werden konnte.[6] Allerdings weist Blut viel mehr Verunreinigungen und niedrigere Aβ-Konzentrationen auf als Zellkulturüberstände und Liquor, sodass der Nachweis von Aβ in Blut mit IP-MS nicht möglich war.
Erster Nachweis von Aβ1-42 und Aβ1-40 in menschlichem Plasma durch Optimierung der Bedingungen für die IP
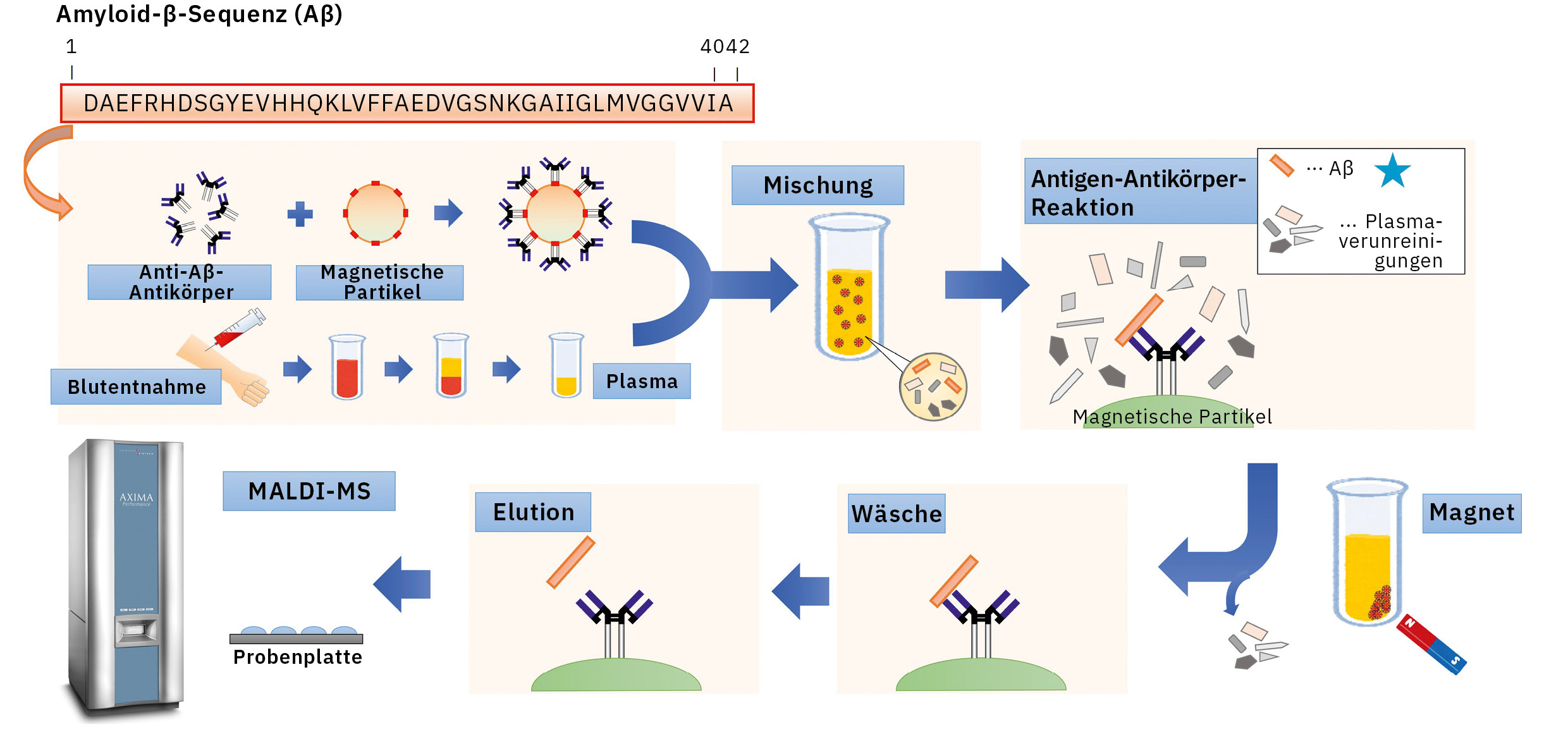
Dank der bei der IP eingesetzten optimierten Bedingungen konnten diese Probleme überwunden werden. Nach der Analyse der Vorbereitung der antikörperbeschichteten Beads, der Tenside und der Eluatzusammensetzungen während der IP wurde eine Zusammensetzung für die Matrixlösung ausgewählt, die sich für die Proben nach der IP eignete, um eine IP-MS-Methode für die Analyse von Plasma-Aβ mittels MALDI-TOF-MS (AXIMA Performance) zu entwickeln (Abbildung 2).
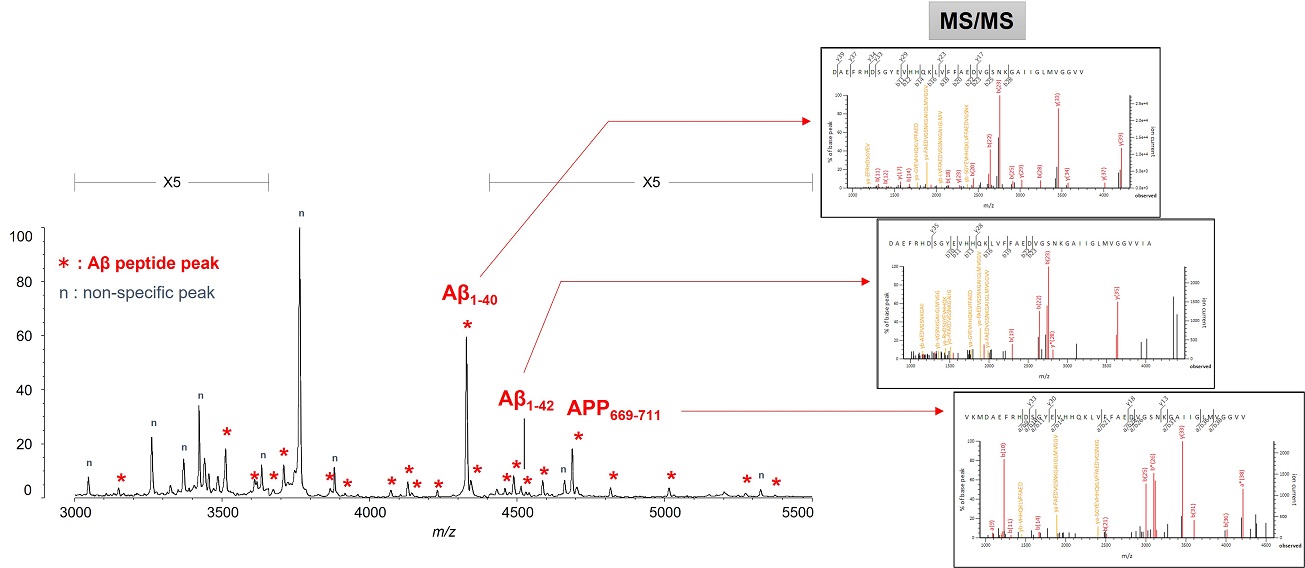
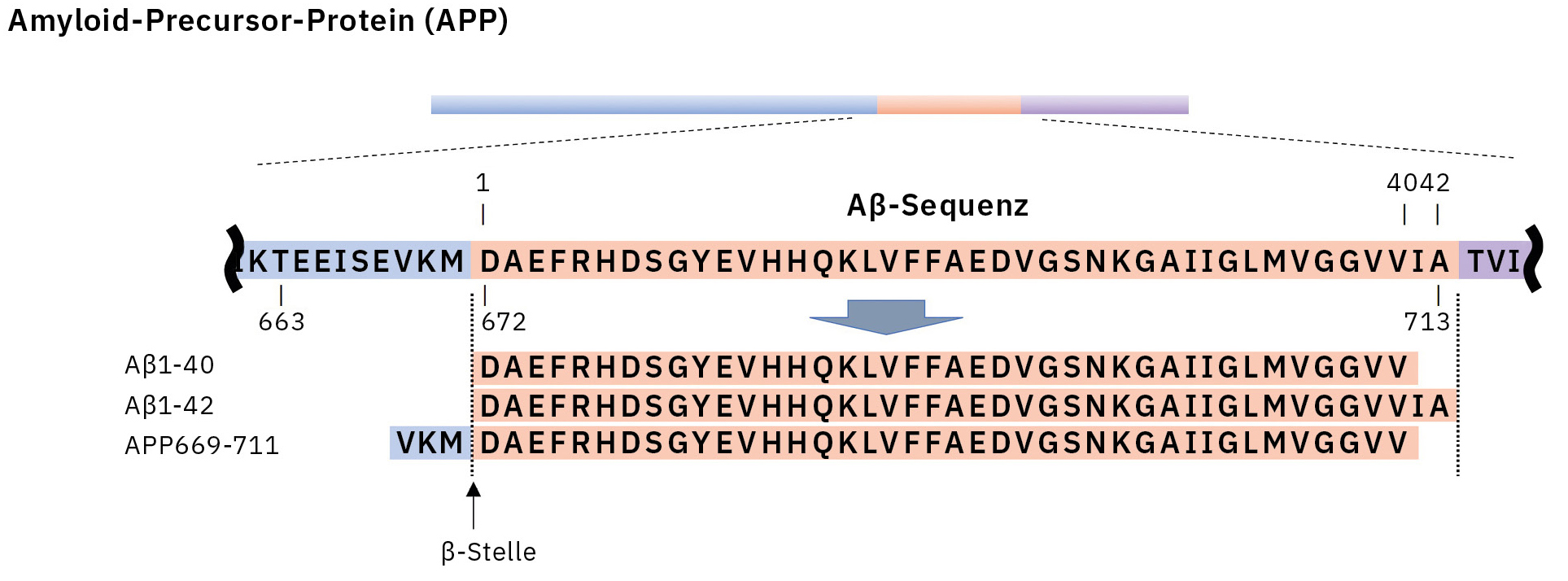
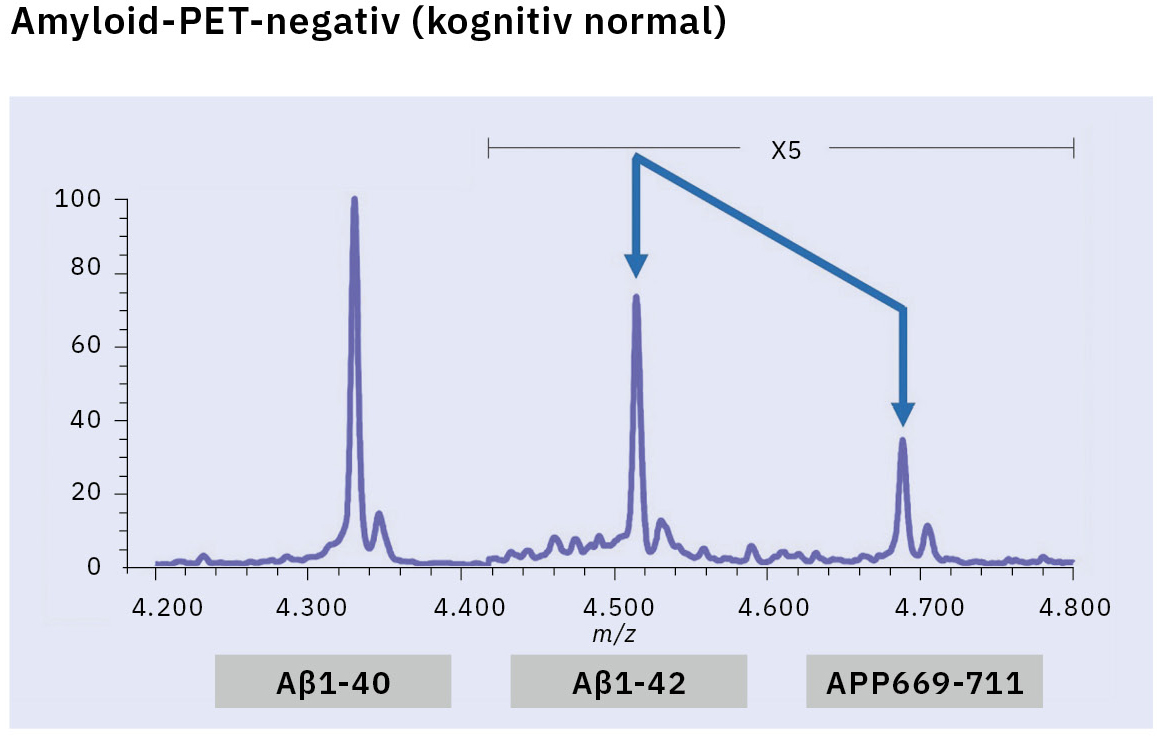
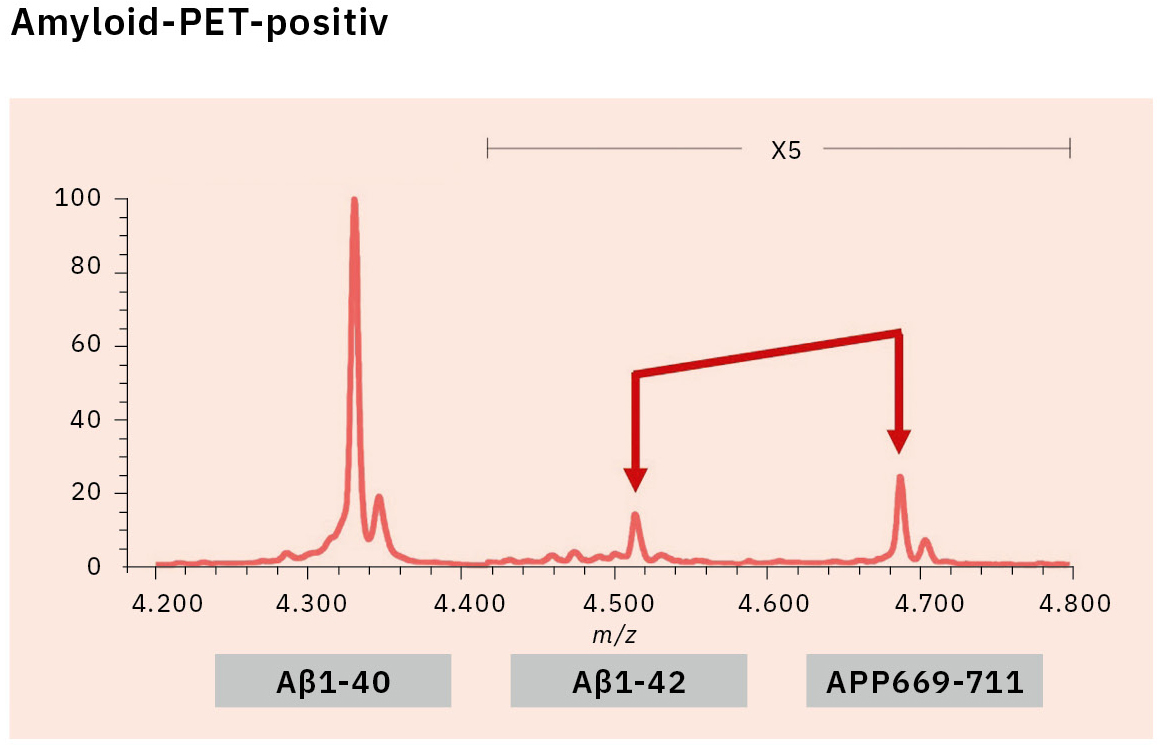
Dieses Verfahren führte zum ersten erfolgreichen Nachweis von endogenem Aβ1-42 und Aβ1-40 in menschlichem Plasma mittels Massenspektrometrie und gleichzeitig zu weiteren Erkenntnissen, die nur mithilfe der Massenspektrometrie gewonnen werden konnten (Abbildung 3).[7, 8] Insbesondere enthüllte die Massenspektrometrie das Vorhandensein vieler anderer Aβ-Spezies als Aβ1-42 und Aβ1-40 im menschlichen Plasma, einschließlich APP669-711 mit einem über Aβ1-x hinaus verlängerten N-Terminus (Abbildung 4). Bei diesem IP-MS-Verfahren unter Verwendung von MALDI-TOF-MS wird die Aβ-Spezies nach der IP ohne Proteaseverdau direkt auf das MALDI-TOF-MS aufgetragen. So lässt sich die Zeit für die Probenvorbereitung einsparen und die im Plasma vorhandenen intakten Aβ-Spezies können gemessen werden.
Umfassende blutbasierte Biomarkerstudien
Die Forschung nach einem Aβ-Biomarker mittels IP-MS begann 2013 in Zusammenarbeit mit dem japanischen National Center for Geriatrics and Gerontology. Im Rahmen dieser Biomarkerfindungsstudie unter Einsatz von IP-MS und Amyloid-PET-Bildgebung mit PIB (62 Fälle) wurde ein höheres Verhältnis von APP669-711 zu Aβ1-42 (APP669-711/Aβ1-42) im Plasma von Amyloid-PET-positiven Patienten nachgewiesen (Abbildung 5).[9] Die ROC-Analyse des APP669-711-/Aβ1-42-Verhältnisses für Amyloid-PET-positive Patienten ergab zudem einen hohen Wert der Fläche unter der Kurve (AUC) von 96,9 %. Das APP669-711-/Aβ1-42-Verhältnis war außerdem signifikant mit dem SUVR der Amyloid-PET korreliert, mit einem Korrelationskoeffizienten von 0,687 (p < 0,001). Ausgehend von diesen Daten wurde 2014 erstmals über eine hohe Übereinstimmung zwischen dem APP669-711-/Aβ1-42-Verhältnis im Plasma und der Amyloid-PET berichtet.
Eine unzureichende Reproduzierbarkeit ist häufig ein Problem bei neu entdeckten blutbasierten Biomarkern, das oftmals dazu führt, dass sie nicht weiterverfolgt werden. Daher war eine Validierung des blutbasierten Biomarkers mit Proben erforderlich, die völlig unabhängig von den in der Findungsstudie verwendeten Proben waren. Unter Verwendung von zwei Datensätzen des japanischen National Center for Geriatrics and Gerontology und der Australian Imaging, Biomarker & Lifestyle Flagship Study of Aging (AIBL) wurde eine Validierungsstudie durchgeführt. Die ROC-Analyse des APP669-711-/Aβ1-42-Verhältnisses für Amyloid-PET-positive Fälle (unter Verwendung des PIB-Tracers) ergab einen hohen AUC-Wert von 92,3 % im japanischen Datensatz (121 Fälle) und von 89,5 % im australischen Datensatz (111 Fälle) (Tabelle 1).[10] Ein zusammengesetzter Biomarker, der durch die Kombination des APP669-711-/Aβ1-42-Verhältnisses und des Aβ1-40-/Aβ1-42-Verhältnisses (eines bekannten Biomarkers) gebildet wurde, verbesserte die AUC-Werte außerdem auf 96,7 % im japanischen Datensatz und auf 94,1 % im australischen Datensatz. Die Konzentration von Aβ1-42 im Liquor nimmt bekanntermaßen ab, wenn sich Aβ im Gehirn ansammelt, ein Phänomen, das auch anhand der Daten zu erkennen war, mit reduzierten Plasmaspiegeln von Aβ1-42 bei Amyloid-PET-positiven Fällen. Diese Veränderung von Aβ1-42 kann dadurch verursacht werden, dass Aβ1-42 im Gehirn zurückgehalten wird, wodurch die Menge an Aβ1-42, die in die Körperflüssigkeiten gelangen kann, sinkt.
Die ROC-Analyse der Blutkonzentration von Aβ1-42 allein ergab ebenfalls AUC-Werte von 87,2 % im japanischen Datensatz und 75,7 % im australischen Datensatz, was darauf hindeutet, dass Aβ1-42 allein als Biomarker ungeeignet ist, obwohl diese AUC-Werte anstiegen, wenn die Aβ1-42-Konzentration ins Verhältnis zu anderen Aβ-Spezies gesetzt wurde. Dieser Anstieg der AUC ist vermutlich auf individuelle Schwankungen in der Gesamtkonzentration aller Aβ-Spezies im Blut zurückzuführen, wodurch die Wirksamkeit der Verwendung der absoluten Aβ1-42-Konzentration allein als Biomarker verringert wird. Die Verwendung von Aβ1-42 als Verhältnis zu einer anderen Aβ-Spezies kann den Einfluss dieser individuellen Variation des Gesamt-Aβ unterdrücken. Dieser 2018 veröffentlichte Bericht belegte eine hohe Übereinstimmung zwischen dem mittels IP-MS gemessenen Plasma-Aβ und der Amyloid-PET und diente als Impulsgeber für die Anerkennung von Blut-Aβ als nützlichem Biomarker durch Forscher weltweit.
Entdeckung von Alzheimer-Medikamenten durch weniger invasive Biomarker, die die Pathologie von Alzheimer widerspiegeln
Mit der Amyloid-MS-Technik können sowohl das einzigartige APP669-711-/Aβ1-42-Verhältnis als auch das Aβ1-40-/Aβ1-42-Verhältnis im Plasma gemessen werden. Der zusammengesetzte Aβ-Biomarker, der durch die Kombination der beiden Aβ-Verhältnisse geschaffen wurde, wies eine hohe Genauigkeit bei der Unterscheidung von Amyloid-PET-positiven Fällen von Amyloid-PET-negativen Fällen auf. Biomarker, die die Pathologie der Alzheimer-Krankheit widerspiegeln, sind für die Entdeckung von Medikamenten, die Diagnose und die Stadieneinteilung bei Alzheimer entscheidend. Blutbasierte Biomarker, die eine weniger invasive Methode zur Messung einer großen Anzahl von Proben bieten, gewinnen zunehmend an Bedeutung.
|
Biomarker |
Bewertung |
NCGG (n = 121) |
AIBL (n = 111) |
|
Aβ1-42 |
AUC |
87,2% |
75,7% |
|
Empfindlichkeit |
74,0% |
78,3% |
|
|
Spezifität |
88,7% |
66,7% |
|
|
Genauigkeit |
82,6% |
73,0% |
|
|
APP669-711/Aβ1-42 |
AUC |
92,3% |
89,5% |
|
Empfindlichkeit |
68,0% |
86,7% |
|
|
Spezifität |
91,5% |
74,5% |
|
|
Genauigkeit |
81,8% |
81,8% |
|
|
Aβ1-40/Aβ1-42 |
AUC |
96,7% |
88,9% |
|
Empfindlichkeit |
96,0% |
90,0% |
|
|
Specificity |
87,3% |
70,6% |
|
|
Genauigkeit |
90,9% |
81,1% |
|
|
Zusammengesetzter Biomarker |
AUC |
96,7% |
94,1% |
|
Empfindlichkeit |
86,0% |
91,7% |
|
|
Spezifität |
88,7% |
82,4% |
|
|
Genauigkeit |
87,6% |
87,4% |
[1] Villemagne V.L. et al. (2013). Amyloid β deposition, neurodegeneration, and cognitive decline in sporadic Alzheimer’s disease: a prospective cohort study. Lancet Neurol. 12 (4): 357–367.
[2] Janelidze S. et al. (2021). Head-to-head comparison of 8 plasma amyloid-β 42/40 assays in Alzheimer disease. JAMA Neurol. 78 (11): 1375–1382.
[3] Brand A.L. et al. (2022). The performance of plasma amyloid beta measurements in identifying amyloid plaques in Alzheimer’s disease: a literature review. Alzheimers Res Ther. 14 (1): 195.
[4] Winston C.N. et al. (2023). Evaluation of Blood-Based Plasma Biomarkers as Potential Markers of Amyloid Burden in Preclinical Alzheimer’s Disease. J Alzheimers Dis. 92 (1): 95–107. doi: 10.3233/JAD-221118. PMID: 36710683.
[5] Shanthi K.B. et al. (2015). A systematic review and meta-analysis of plasma amyloid 1-42 and tau as biomarkers for Alzheimer’s disease. SAGE Open Med. 3: 2050312115598250.
[6] Wang R. et al. (1996). The profile of soluble amyloid beta protein in cultured cell media. Detection and quantification of amyloid beta protein and variants by immunoprecipitation-mass spectrometry. J Biol Chem. 271 (50): 31894–31902.
[7] Kaneko N. et al. (2014). Identification and quantification of amyloid beta-related peptides in human plasma using matrix-assisted laser desorption/ionization time-of-flight mass spectrometry. Proc Jpn Acad Ser B Phys Biol Sci. 90 (3): 104–117.
[8] Korecka M., Shaw L.M. (2021). Mass spectrometry-based methods for robust measurement of Alzheimer’s disease biomarkers in biological fluids. 159 (2): 211–233.
[9] Kaneko N. et al. (2014). Novel plasma biomarker surrogating cerebral amyloid deposition. Proc Jpn Acad Ser B Phys Biol Sci. 90 (9): 353–364.
[10] Nakamura A. et al. (2018). High performance plasma amyloid-β biomarkers for Alzheimer’s disease. Nature. 554 (7691): 249–254.